Содержание
Вирион
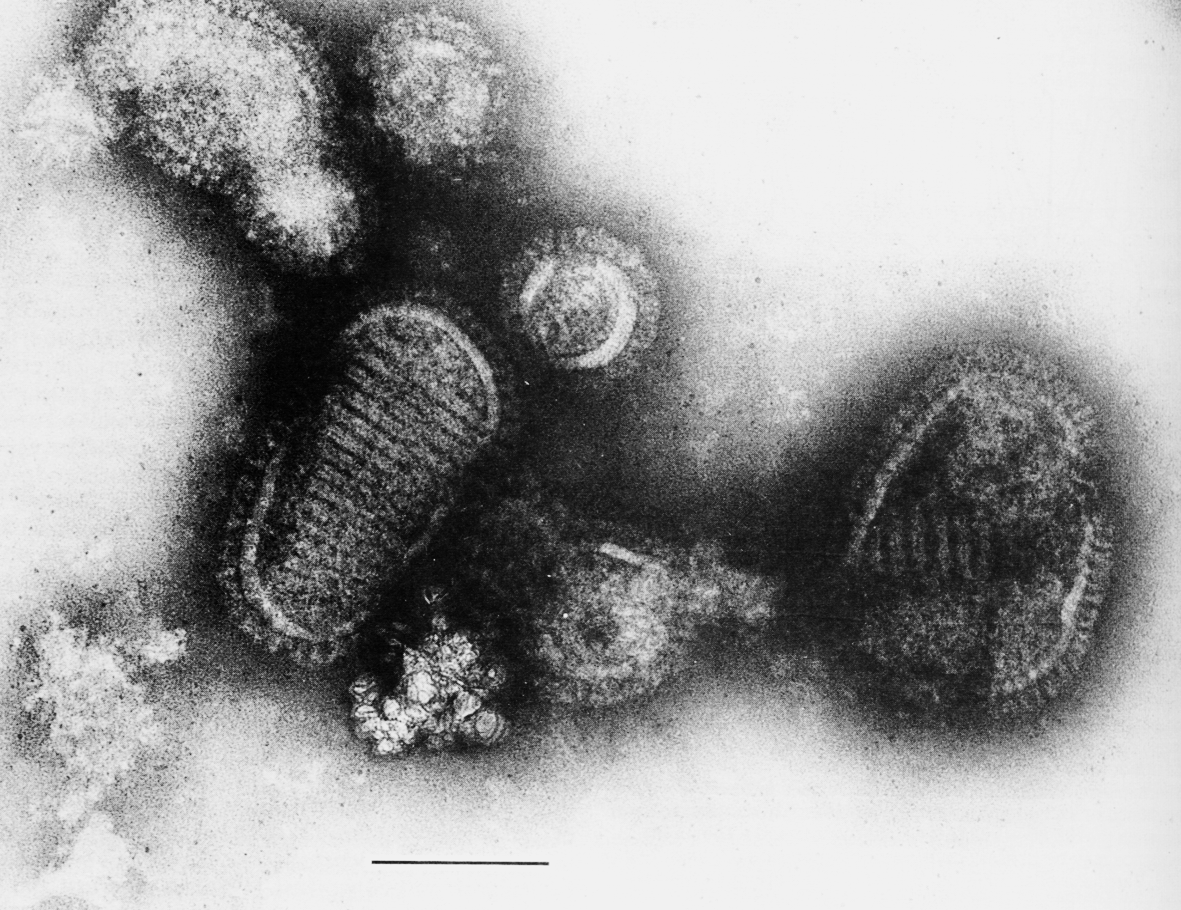
Вирусы гриппа представляют собой частицы плеоморфной (обычно сферической) формы, среднего для вирусов размера (80—120 нм в диаметре). Они содержат РНК, которая упакована в комплексе с белками в виде спирали (кор, или нуклеокапсид) и окружена внешней оболочкой (суперкапсид). На поверхности вирионов имеется множество мелких шипов, построенных из гликопротеинов с гемагглютинирующей или нейраминидазной активностью (рис. 3). У вируса типа С нейраминидаза отсутствует; ее заменяет ацетилэстераза, отрезающая ацетильные группы гликопротеинов.
РНК обладает негативной полярностью (минус-нить). Это означает, что, попав в клетку, она не может напрямую (без транскрипции) выполнять функции мРНК. Но главная особенность генома — фрагментарность. РНК расчленена на 8 (типы А и В) или 7 (С) сегментов, большинство из которых кодируют единственный белок, т.е. являются моноцистронными генами. Один из сегментов кодирует неструктурные протеины (NS1 и NS2), существующие только в инфицированных клетках.
Вирион состоит из 7 белков, которые, как и у всех оболочечных вирусов, делятся на внутренние и поверхностные. К внутренним относятся матриксный белок (М) и белки сердцевины: нуклеопротеин (NP) и ферменты полимеразного комплекса. Поверхностные белки представлены гемагглютинином и нейраминидазой (вирусы А и В).
М-белок расположен на внутренней поверхности суперкапсида, сопрягая его с сердцевиной. Это стабилизирующее начало вириона, и при его отсутствии или неполноценности вирусная частица теряет прочность, быстро распадаясь на субкомпоненты. Нуклеопротеин образует чехол (капсид) вокруг РНК, не утрачивая с ней связи на протяжении всего репликативного цикла. Это не только не мешает экспрессии генов, но даже помогает транскрипции и репликации. Белки РВ1, РВ2 и РА являются ферментами, играя ключевую роль в манипуляциях с вирусными РНК внутри зараженных клеток (см. ниже). РВ1 и РВ2 обладают основными (англ. basic), а РА — кислыми (англ. acidic) свойствами. Это послужило поводом для их названия, В или А.
Все внутренние белки — типоспецифические антигены. Это означает, что их эпитопный профиль радикально отличается у разных типов вируса гриппа, но практически идентичен для всех штаммов каждого из них. Собственно, и само подразделение на типы (виды), как уже говорилось, имеет серологическую основу, базируясь на антигенной дискретности А-, В- и С-нуклеопротеинов. Антитела против внутренних антигенов лишены защитного действия.
Поверхностные белки (гемагглютинин и нейраминидаза) входят в состав суперкапсида. Это лицо вируса, по которому можно отличить близких родственников, судить об их эпидемических претензиях и взаимоотношениях с хозяином. Они заякорены гидрофобными концами в липидном бислое суперкапсида и структурно оформлены в виде шипов, выступающих на поверхности вириона (см. рис. 3). Изнутри гемагглютинин и нейраминидаза контактируют с М-белком, а через него — с сердцевиной.
Гемагглютинин (Н) выполняет рецепторную функцию при заражении клеток. Это объясняется его сродством к сиалированным гликопептидам и гликолипидам, благодаря которому вирионы закрепляются на плазматической мембране. Во взвеси с эритроцитами человека и многих животных вирусные частицы одновременно соединяются с двумя клетками, вызывая гемагглютинацию. Эта простая реакция имеет большое индикаторное значение и широко используется в дифференцировке вирусных штаммов, диагностике гриппа и оценке протективных ресурсов иммунитета.
Но значение гемагглютинина не ограничивается физическими контактами между вирусом и клеткой. Он продолжает действовать и на последующих этапах инфекции, способствуя выходу свободного нуклеокапсида в цитоплазму. Это происходит в кислой среде эндосом (фаголизосом), благодаря обнажению специальных структур гемагглютинина (так называемых сайтов слияния), которые возбуждают объединение вирусной и клеточной мембран. Полифункциональность гриппозного гемагглютинина уникальна: у других вирусов (например, у тех же парамиксовирусов) функции рецепции и слияния поделены между разными белками. Кроме того, гемагглютинин выполняет роль главного протективного антигена: антитела к нему нейтрализуют вирус и подавляют развитие инфекции.
Гемагглютинин синтезируется и включается в состав вириона в виде предшественника, который способен реагировать с рецепторами клеток, но не обеспечивает слияния вирионной оболочки с клеточными мембранами. Для реализации этой важнейшей функции (см. ниже) гемагглютинин должен пройти через этап ограниченного протеолиза. В условиях естественной инфекции его вызывают сериновые протеазы, которые в изобилии содержатся в респираторных секретах. Они расщепляют гемагглютинин на два связанных между собой дисульфидным мостиком фрагмента — Н1 и Н2. После дополнительных конформационных изменений в кислой среде эндосом Н2 внедряется своим гидрофобным концом в липидный бислой клеточной мембраны, инициируя процесс слияния. Без такой поддержки со стороны хозяина вирус биологически инертен. Это одна из причин великолепного размножения вирусов гриппа в курином эмбрионе и культуре клеток птиц, которые очень богаты протеазами, расщепляющими гемагглютинин. В культурах клеток млекопитающих, лишенных протеазной активности, образуются вирионы с нерасщепленным гемагглютинином. Они нормально прикрепляются к клеткам-хозяевам и агглютинируют эритроциты (результат активности Н1), но неинфекционны. Добавление в среду трипсина обеспечивает репликацию вируса и цитопатический эффект.
Нейраминидаза (N) образует отдельные шипы, которых в несколько раз меньше, чем гемагглютинина. Это фермент, отщепляющий N-ацетилнейраминовую (сиаловую) кислоту от гликопептидов и гликолипидов (ганглиозидов), т.е. по сути инактивирующий рецепторы для гемагглютинина. В этом легко убедиться, наблюдая за вирусиндуцированной гемагглютинацией: агрегаты эритроцитов, стабильные при 4оС, быстро распадаются при 37оС, так как нейраминидаза откусывает гемагглютинин вместе с сиаловой кислотой. Нечто подобное происходит и во время инфекционного процесса. Нейраминидаза отделяет вирионы от сиалированных муцинов, покрывающих слизистую оболочку, способствуя продвижению вируса к поверхности эпителиальных клеток. При завершении репликативного цикла она помогает отделению созревших вирионов от эпителиоцитов. И в том и в другом случае нейраминидаза действует как фактор распространения, расширяя зону инфекции. Поэтому антитела к нейраминидазе обладают защитным действием, хотя и более слабым, чем антитела против гемагглютинина. В клеточных культурах они сокращают размер, но не количество вирусных колоний. Это говорит о торможении распространения вируса от клетки к клетке при сохранении числа инфекционных вирусных частиц, т.е. об отсутствии вируснейтрализующего эффекта.