Содержание
Основные вопросы, которые следует задавать, применяя антибиотик, сводятся к следующему:
- что он из себя представляет (химическая структура, природный или синтетический продукт);
- как он действует (мишень, механизм действия);
- фармакодинамика (всасывание, распределение в тканях организма, метаболизм и экскреция) и отсюда предпочтительный способ применения;
- когда его следует применять (спектр активности и главные клинические ситуации);
- возможные проблемы (токсичность, микробная резистентность);
- стоимость (значительные колебания цен позволяют выбрать близкий, но более дешевый препарат).
Мы остановимся лишь на микробиологических аспектах проблемы, связанных с механизмом действия антибиотиков, лекарственной резистентностью бактерий, и принципах ее преодоления.
Сегодня широко практикуется эрлиховский принцип химических вариаций, когда, нащупав рациональную основу, искусственно синтезируется множество новых антибиотиков, из которых отбирают удачные экземпляры. Особенно богатым источником природного сырья оказались актиномицеты, прежде всего стрептомицеты. Это «атипичные» бактерии, которые имеют формальное сходство с плесневыми грибами, образуя мицелиальные формы. Стрептомицеты являются высшими актиномицетами, так как, подобно грибам, размножаются спорами.
Классификация по химическим свойствам основана на базисном сходстве молекул. Иногда его непросто заметить (по крайней мере, не химику-профессионалу) в изобилии второстепенных деталей, от которых зависит клиническая ценность препарата. Практически важным является представление о преимущественной направленности, широте и ограниченности антимикробного эффекта антибиотических препаратов, их фармакодинамических параметрах. Большой интерес вызывают механизмы, определяющие активность антибиотиков, молекулярные мишени, на которые направлено их действие, и способы, благодаря которым бактерии избегают гибели.
Механизмы антибактериального эффекта
Общим для всех антибиотиков является то, что они влияют на бактерии в фазе активного роста и размножения. Это связано с тем, что антибиотики вмешиваются в метаболизм бактериальных клеток, обычно не повреждая готовые структуры покоящихся бактерий. Этим можно объяснить их опережающее воздействие на патогенные бактерии при относительно слабом влиянии на нормальную микрофлору. Патогенетически значимая колонизация требует от возбудителей быстрого размножения и усиленной метаболической активности. Это повышает уязвимость бактерий для антимикробных агентов. Лишь длительное применение антибиотиков, поддерживающее их концентрацию в организме, создает угрозу малоактивным бактериям.
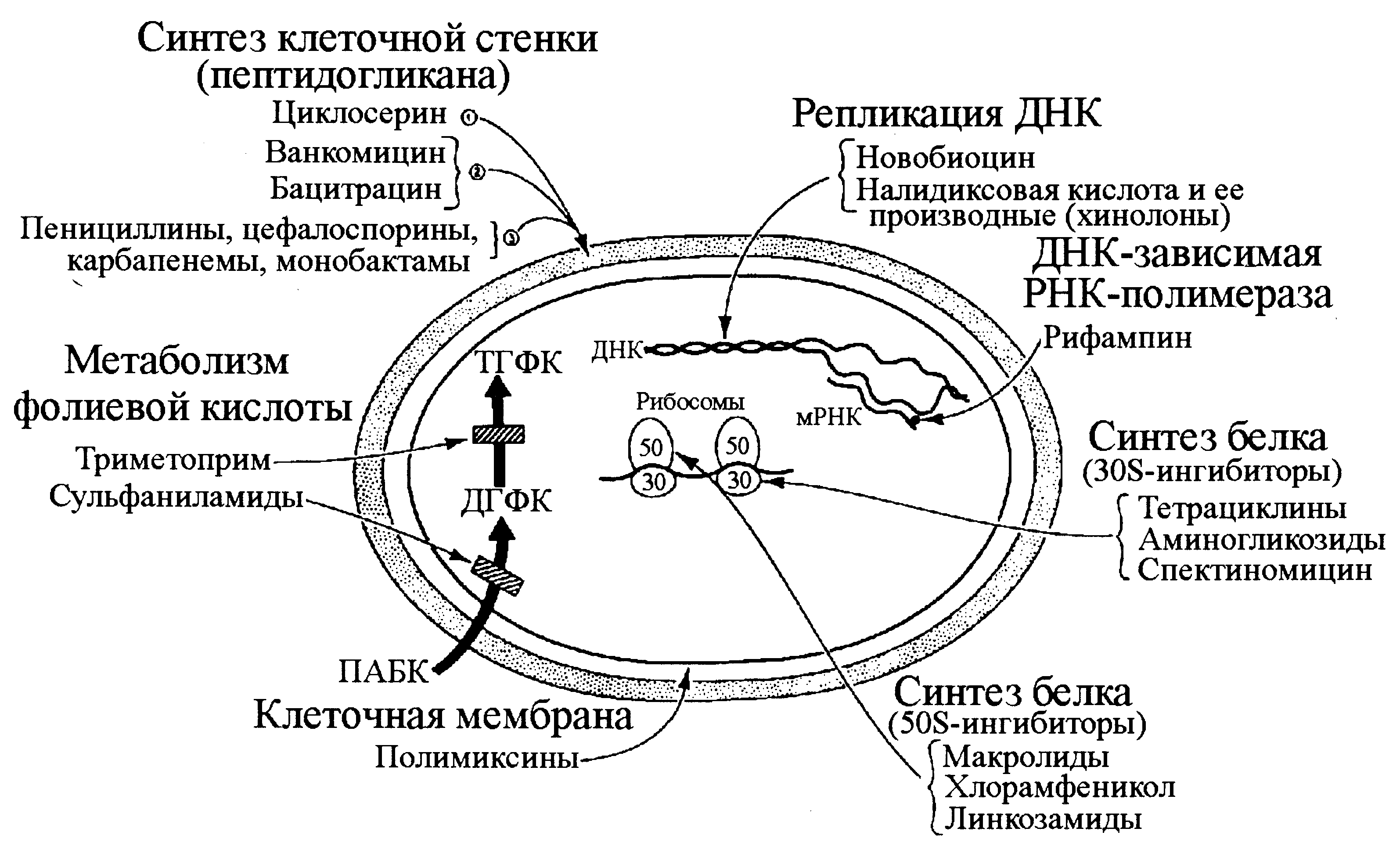
ДГФК — дигидрофолиевая кислота, ТГФК — тетрагидрофолиевая кислота
Отсюда следует практически важный вывод: антибиотики при хронических инфекциях менее эффективны, чем при острых, и едва ли полезны при бессимптомном и малосимптомном носительстве болезнетворных бактерий, репликативная активность которых в подобных случаях не отличается от нормофлоры.
Основные точки действия антибактериальных агентов проиллюстрированы на рис. 4.
Ингибиторы синтеза клеточной стенки бактерий (антипептидогликановые антибиотики)
Клеточная стенка бактерий — идеальная мишень для высокоизбирательного антибактериального эффекта, так как ее структурная основа, пептидогликан (или муреин, от лат. murus — стенка), уникальна и жизненно необходима для прокариотов. Эукариотические клетки лишены не только пептидогликана, но и всей атрибутики, необходимой для его синтеза.
Пептидогликан определяет механическую прочность клеточной стенки, позволяя выдерживать высокое осмотическое давление бактериальной цитоплазмы. Это гетерополимер, построенный из параллельных полисахаридных (гликановых) цепей, которые состоят из чередующихся аминосахаров (N-ацетилглюкозамин и N-ацетилмурамовая кислота), однотипных боковых тетрапептидов, связанных с N-ацетилмурамовой кислотой, и межпептидных мостиков, состоящих из нескольких аминокислот. Межпептидные мостики сшивают пептидогликановые цепи, превращая их в единую многослойную макромолекулу (рис. 5), которая непрерывным слоем окружает протопласт (рис. 6).
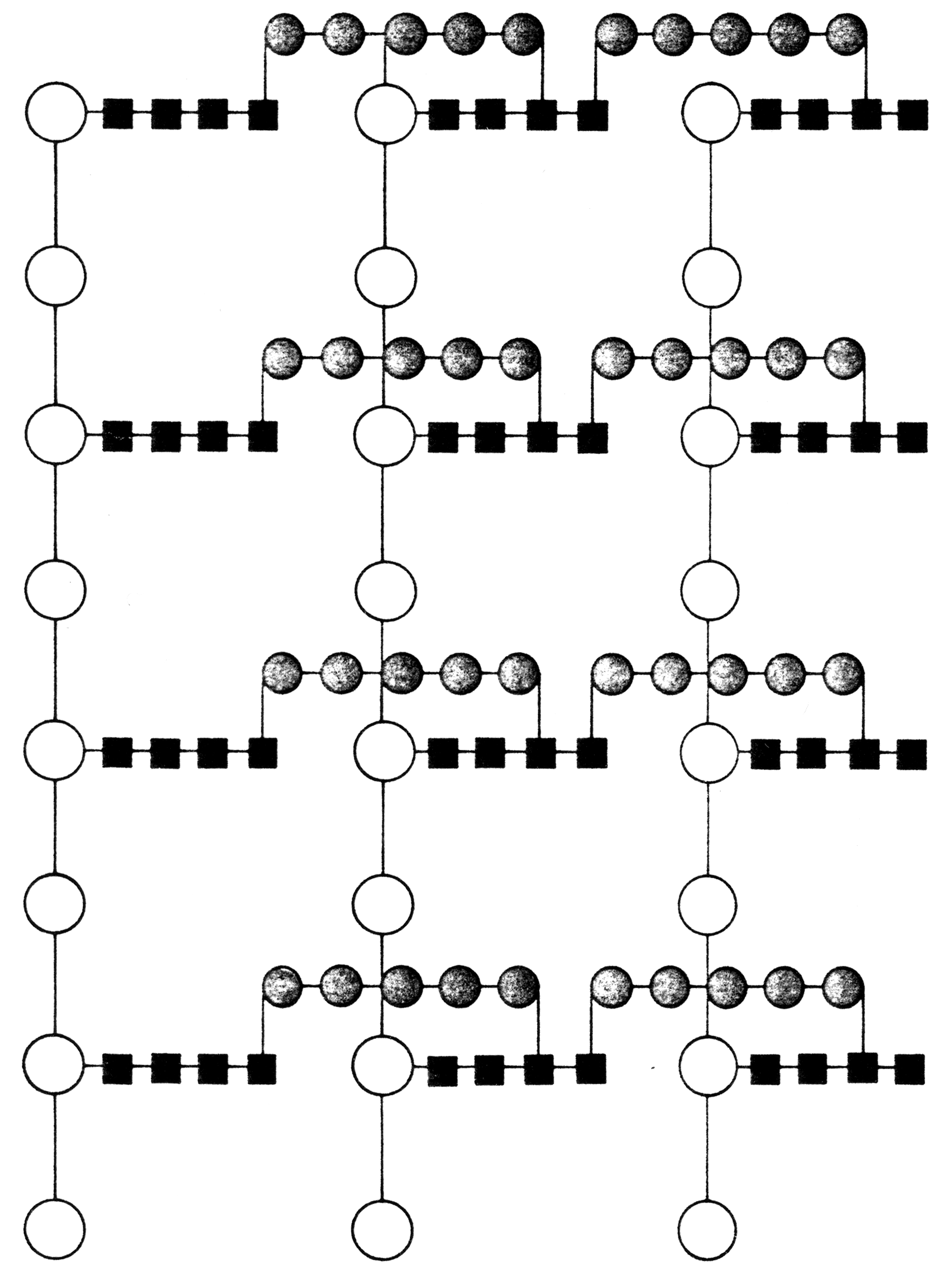
Рис. 6. Электронограммы клеток (а) и пептидогликана (б) золотистого стафилококка
У грамотрицательных бактерий боковые тетрапептиды соединены напрямую пептидной связью, оставляя концевую аминокислоту (d-аланин) для стыковки (через липопротеин) с наружной мембраной (рис. 7). Все пептидогликаны построены по общей схеме с видовыми вариациями в пептидных (транспептидных) субъединицах.
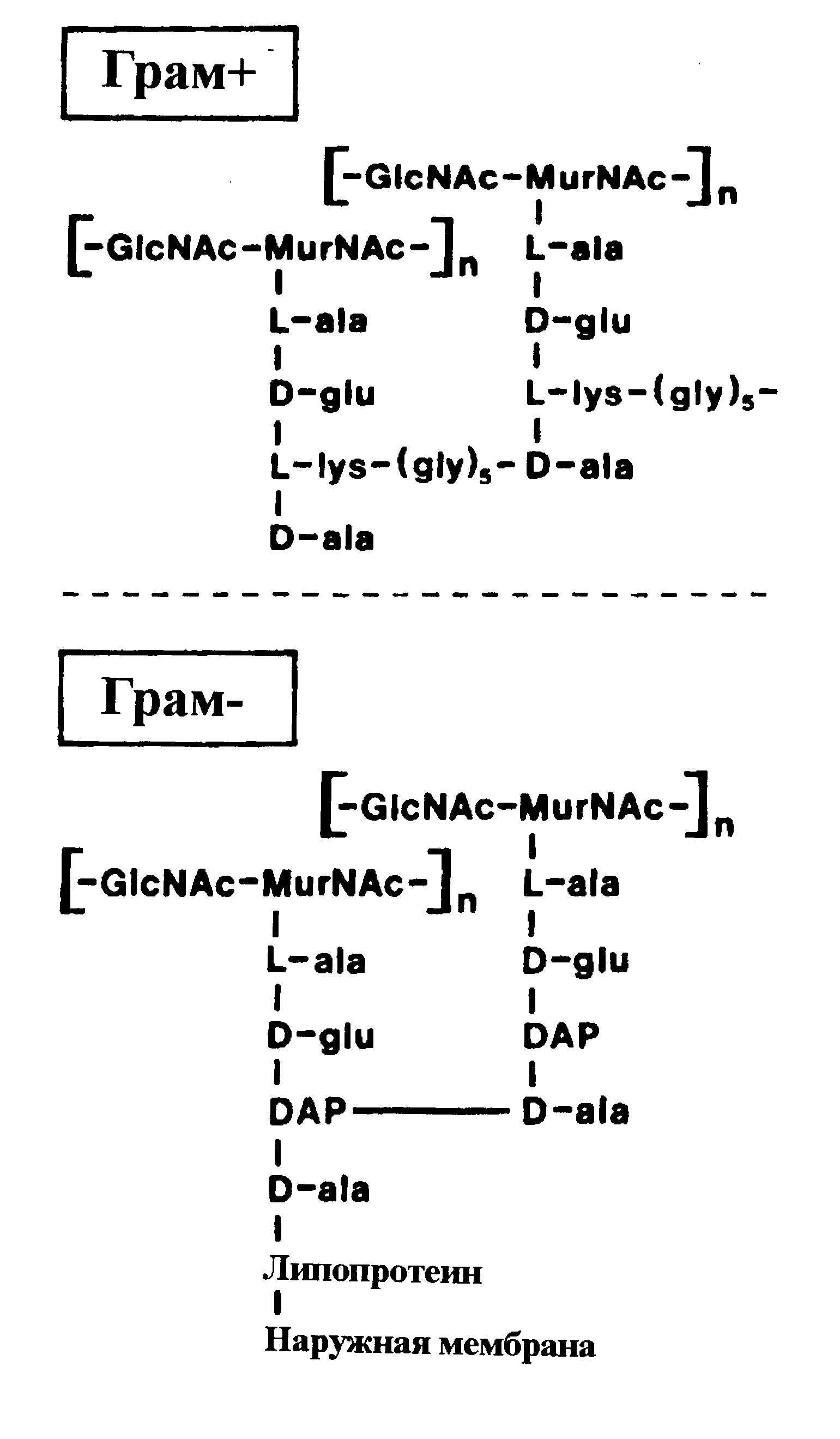
протеином, который соединен с наружной мембраной
Пептидогликан есть почти у всех бактерий. Важными в медицинском отношении исключениями являются микоплазмы и хламидии. Это означает, что они не чувствительны к антибиотикам, блокирующим синтез клеточной стенки.
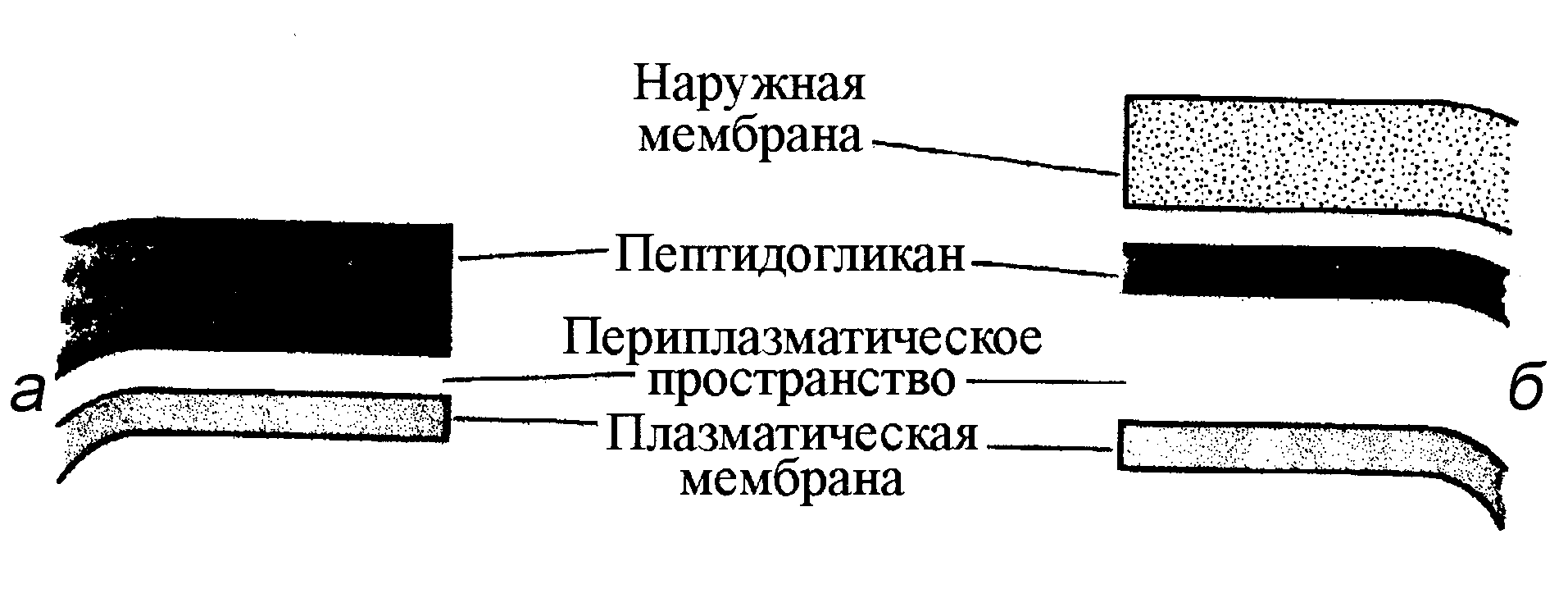
Особенно мощный пептидогликановый каркас имеют грамположительные бактерии. У грамотрицательных бактерий он много тоньше, хотя это компенсируется наличием наружной мембраны, которая, выполняя ряд важных метаболических и патогенетических функций, служит дополнительной защитой, в том числе от антибиотиков (рис. 8).
Синтез пептидогликана включает три базисных этапа:
1) образование (в цитоплазме) гликопептидных субъединиц и их транспорт в цитоплазматическую мембрану;
2) объединение субъединиц в гликопептидные цепи (это происходит в плазматической мембране);
3) сшивание пептидогликановых цепей межпептидными связями с образованием пептидогликанового каркаса.
Этот этап совершается на внешней поверхности плазматической мембраны под влиянием ферментов — транспептидаз. Они известны как пенициллинсвязывающие белки, потому что служат мишенью для бета-лактамных антибиотиков.
Антипептидогликановые антибиотики действуют бактерицидно, вызывая лизис бактерий. Но они лишь запускают процесс: завершение обеспечивают собственные ферменты бактерий — аутолизины. Их физиологическая функция состоит в контролируемом расщеплении пептидогликана при делении бактериальных клеток. Антибиотики неизвестным способом снимают этот контроль, провоцируя саморазрушение клеточной стенки и разрыв плазматической мембраны. Без такой поддержки антибиотики лишь блокируют синтез пептидогликана. В этом их принципиальное отличие от антипептидогликановых ферментов — мурамидаз, действующих по типу лизоцима. Бактериальные аутолизины принадлежат к этой категории.
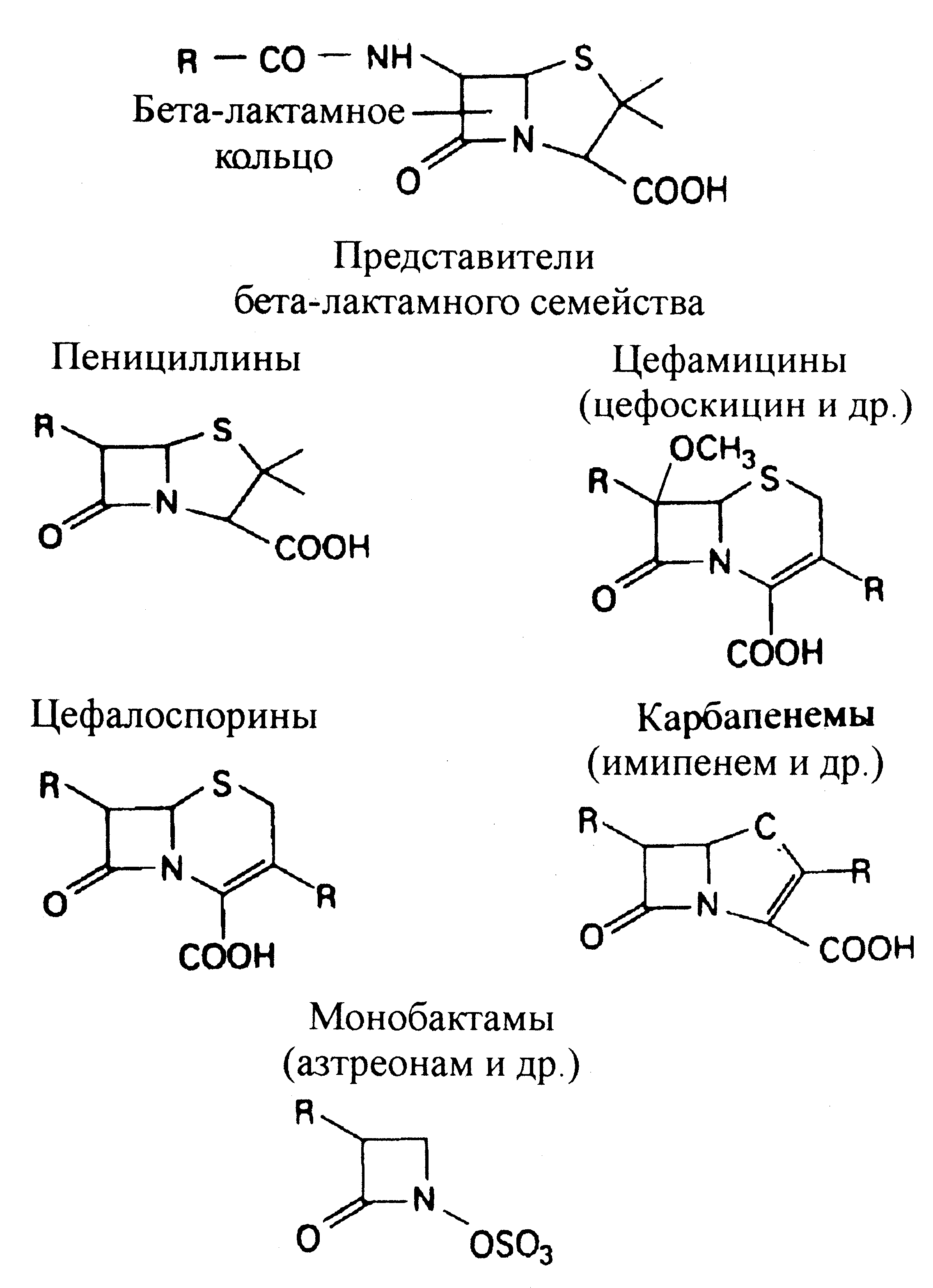
Почти все антибиотики, блокирующие синтез клеточной стенки, относятся к семейству бета-лактамов (см. таблицу). Их структурная и функциональная основа представлена бета-лактамным кольцом (рис. 9), которое связывается с транспептидазами, препятствуя завершению синтеза пептидогликанового каркаса. Наиболее важными бета-лактамами являются пенициллины и цефалоспорины. Они представлены множеством структурных модификаций природных субстратов — пенициллина (продукт гриба рода Penicillium) и цефалоспорина (грибы рода Cephalosporium). Впрочем, и другие бета-лактамы (особенно карбапенемы и монобактамы) зарекомендовали себя как перспективные антибиотики и служат предметом активного применения.