Содержание
Кроме бета-лактамов, синтез клеточной стенки блокируют гликопептидные антибиотики (ванкомицин, тейкопланин), а также бацитрацин и циклосерин. Они действуют на более ранних этапах синтеза пептидогликана, подавляя образование гликопептидных субъединиц (циклосерин) и их полимеризацию в гликопептидные цепи (ванкомицин, бацитрацин).
Ингибиторы синтеза белка (антирибосомальные антибиотики)
Синтез белка, в основе которого лежит трансляция мРНК на рибосомах — многоступенчатый процесс, где задействовано множество ферментов и структурных субъединиц. Поэтому не случайно, что такая сложная система является мишенью для антибиотиков. По ряду признаков белоксинтезирующий аппарат прокариот отличается от рибосом эукариотических клеток. Бактериальные рибосомы состоят из меньших по размеру субъединиц (30S и 50S — прокариоты, 40S и 60S — эукариоты), более мелких молекул РНК и включают меньше белков. Принципиально, что эти различия находят качественное выражение, определяя селективность мишеней рибосомального цикла для антибактериальных воздействий (рис. 10). Аминогликозиды и тетрациклины связываются с 30S-субъединицей, нарушая образование инициаторного рибосомального комплекса. Тетрациклины обладают бактериостатическим эффектом, обратимо блокируя присоединение к рибосомам инициаторной аминоацил-транспортной РНК (формилметионил-тРНК).
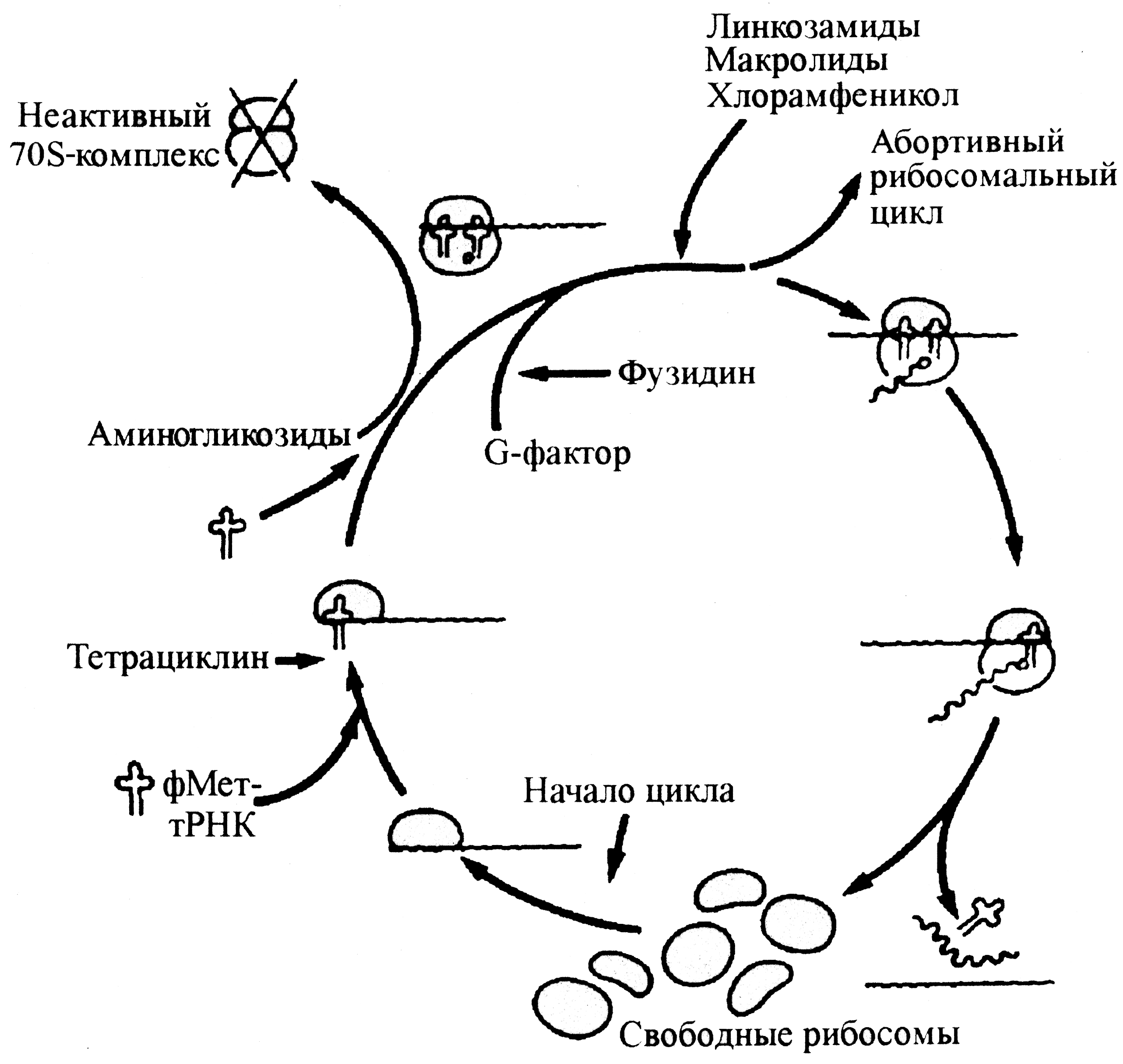
цикл)
Аминогликозиды убивают бактерии, вызывая образование функционально непригодных (неспособных к диссоциации—реассоциации) 70S-рибосом, а также извращая считывание информации с матричной РНК (мРНК). Макролиды, хлорамфеникол, линкомицин/клиндамицин соединяются с 50S-субъединицей вблизи сайта, фиксирующего аминоацил-тРНК. Это обрывает элонгацию (удлинение) пептидных цепей. В отличие от аминогликозидов и тетрациклинов, блокирующих синтез белка в момент его зарождения, здесь прерывается уже начавшийся цикл. После удаления антибиотика процесс возобновляется, т.е. эффект бактериостатичен. К такому же финалу ведет фузидиновая кислота (фузидин), но механизм здесь иной — инактивация фермента (транслоказы, или фактора элонгации G), который обеспечивает передвижение рибосомы по мРНК, создавая условия для включения в пептидную цепь очередной аминокислоты.
Ингибиторы синтеза нуклеиновых кислот
Дискриминация нуклеиновых кислот достигается тремя способами: 1) блокада синтеза предшествеников пурин-пиримидиновых оснований (сульфаниламиды), 2) подавление репликации ДНК (хинолоны, метронидазол) и 3) инактивация РНК-полимеразы (рифамицины).
Клиническим лидером рифамицинов является рифампицин (рифампин). Он связывается с РНК-полимеразой, блокируя транскрипцию, т.е. синтез матричных РНК. Избирательная токсичность основана на том, что бактериальные полимеразы по аффинности к рифамицинам превосходят аналогичные ферменты высших клеток.
Действие метронидазола проявляется после восстановления его нитрогруппы бактериальными белками — ферродоксинами. Это превращает метронидазол в мутаген, способный взаимодействовать и повреждать ДНК бактерий. Ферродоксины имеются у облигатных анаэробов и микроаэрофилов, но отсутствуют в аэробах и факультативных анаэробах. На них метронидазол не действует.
Большой интерес вызывают фторхинолоны. Они (так же, как сульфаниламиды и метронидазол) не относятся к «истинным» антибиотикам, являясь продуктами, синтезированными на основе налидиксовой кислоты. Эффект хинолонов связан с инактивацией ДНК-гиразы — фермента, обеспечивающего суперспирализацию (упаковку) бактериальной хромосомы. Без этого ДНК не помещается в клетках, что делает бактерии нежизнеспособными. Сходные ферменты (топоизомеразы) высших животных не чувствительны к хинолонам.
Ингибиторы цитоплазматической мембраны
Число антибиотиков, специфически действующих на мембраны бактерий, невелико. Наиболее известны тиротрицин (смесь грамицидина и тироцидина) и полимиксины — циклические полипептиды, к которым чувствительны только грамотрицательные бактерии. Они лизируют клетки, действуя как катионные детергенты, т.е. повреждая фосфолипидный матрикс клеточных мембран. Их избирательность значительно уступает другим антибиотикам, так как мембраны бактерий и высших клеток имеют много общего. Из-за токсичности они применялись лишь для лечения местных процессов и не вводились парентерально. В настоящее время не применяются.
Мембранотропностью обладают полиеновые антибиотики (амфотерицин В, нистатин, леворин), которые используются в терапии грибковых заболеваний. Они повреждают мембраны, связываясь со стерольными группировками. Бактерии не чувствительны к полиенам, так как за исключением микоплазм лишены стеролов. Этого нельзя сказать о клетках высших животных, поэтому отыскать специфические мишени для антигрибковых препаратов весьма непросто. К счастью, и здесь удалось «зацепиться»: в отличие от млекопитающих, у которых доминирует холестерол, плазматическая мембрана грибов содержит его химический родственник — эргостерол. В этой связи показательны наблюдения о возможности избирательной блокады стерольного синтеза у грибов. Этого удалось добиться при помощи азольных производных, которые ингибируют один из ключевых ферментов биосинтеза эргостерола — цитохром Р450-деметилазу (ланостерол С14-деметилазу). Такой же фермент есть у человека и других млекопитающих. Он обеспечивает образование холестерола и менее чувствителен к соединениям группы азолов. Кроме средств для наружного применения (клотримазол, миконазол и др.), на этой основе разработаны препараты для лечения системных микозов — кетоконазол и флюконазол. Последний особенно успешно используется в лечении кандидозных инфекций. Это еще один пример, когда на помощь естественным антибиотикам приходят синтетические продукты, не известные живой природе.
Резистентность бактерий к антибиотикам
Бытует легенда, что, комментируя восторг по поводу успешного применения пронтозила (родоначальника сульфаниламидов), И.П. Павлов говорил, что, действуя на микробы, следует помнить об их собственных интересах. Главный интерес — не оригинален. Как и у всего живого — это стремление к выживанию, т.е. к закреплению себя в биосфере. Фраза оказалась пророческой. Возможности бактерий к развитию устойчивости против антибактериальных агентов превзошли многие пессимистические прогнозы. Вслед за стафилококком волна адаптивных перестроек захватила и другие бактерии, сделав проблему универсальной. Резистентность и ее преодоление стали по сути самостоятельным разделом в учении об антибиотиках и антимикробной терапии, побуждая непрерывно трудиться над разрешением этого «реприманда природы».
В медицинском смысле резистентными следует считать бактерии, если они не обезвреживаются такими концентрациями агента, которые возникают в организме при введении фармакологических, т.е. клинически реальных дозировок. Опасная тенденция нарастания устойчивости к антибиотикам поддерживается генами резистентности (r-генами) и условиями, способствующими их распространению. В считанные десятилетия (даже годы) лекарственная резистентность превратилась в тревожную клинико-эпидемиологическую проблему, значение которой особенно велико для внутрибольничных инфекций. Одним из характерных признаков так называемых госпитальных штаммов является множественная устойчивость к антибиотикам, которая возникает в результате широкого обмена r-генами и селекции резистентных штаммов на фоне обильного применения антибактериальных препаратов.
Понять природу лекарственной устойчивости бактерий помогает представление об общих принципах реализации антимикробного эффекта. Они сводятся к следующему: агент 1) должен связаться с бактериями и пройти через их оболочку; 2) должен быть доставлен к месту действия и 3) вступить во взаимодействие с внутриклеточными мишенями. Формирование устойчивости возможно на каждом из этих этапов. Бактерии действуют, как квалифицированные биохимики, изобретая и совершенствуя способы борьбы против нацеленной на них агрессии.