Содержание
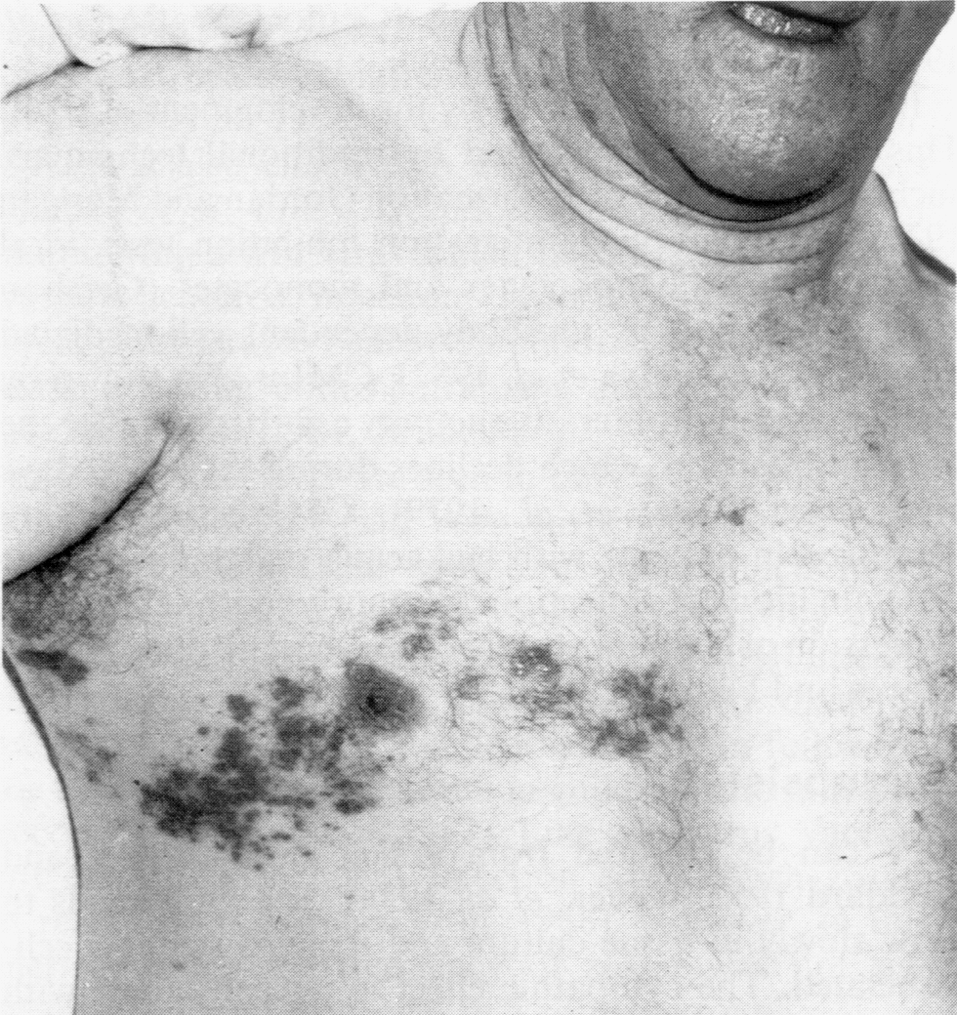
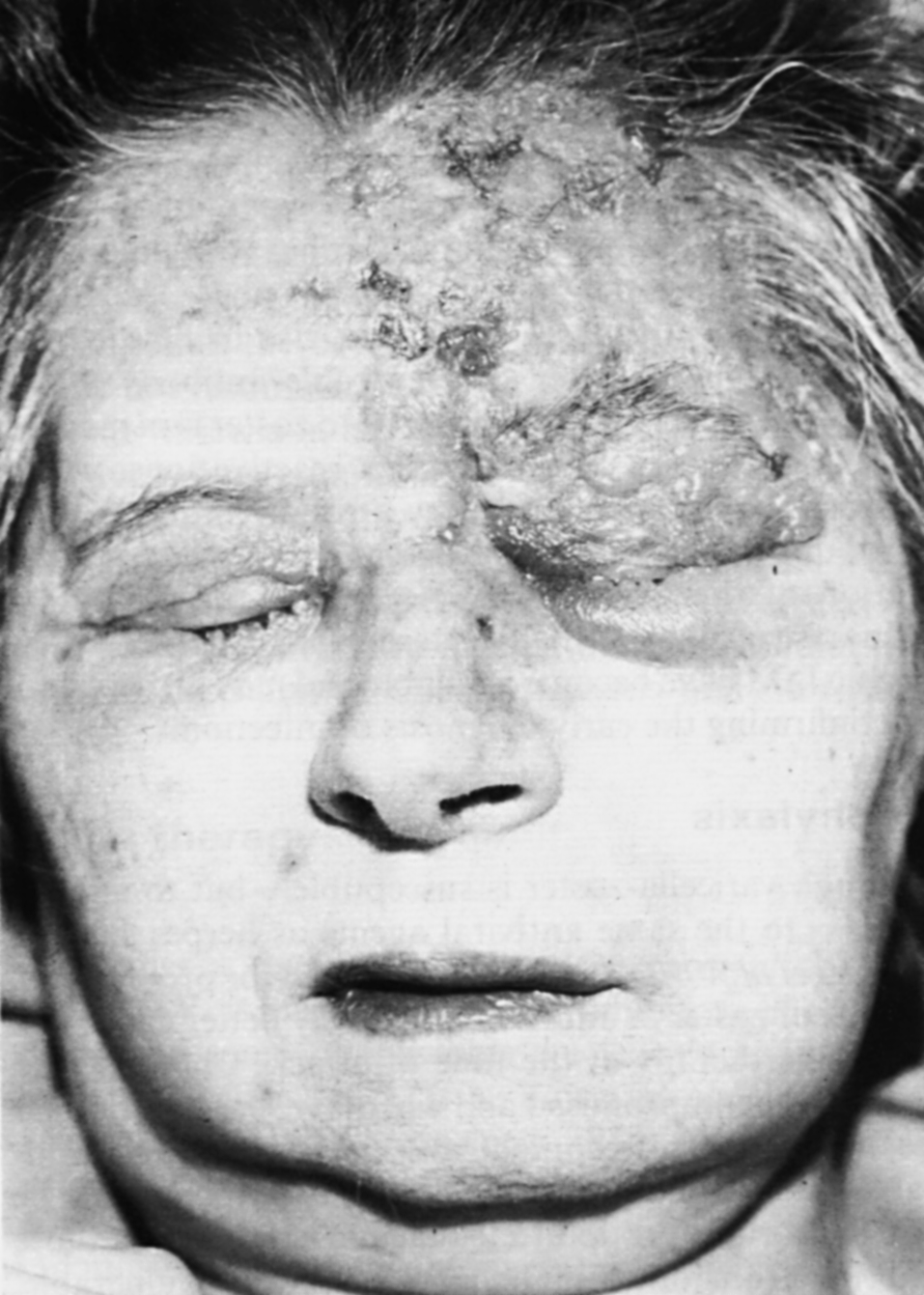
Внешним признаком опоясывающего герпеса являются везикулезно-эрозивные высыпания на коже, напоминающие экзантему при ветряной оспе. Они имеют характерную локализацию, возникая по ходу чувствительных нервов. Чаще поражаются зоны, иннервируемые из грудных ганглиев спинного мозга. В таких случаях сыпь опоясывает туловище от позвоночника до средней вентральной линии (рис. 10). Почти столь же типичны поражения лица, особенно по ходу глазного ответвления тройничного нерва (рис. 11); вовлечение в процесс роговицы чревато нарушением зрения. Поражения других участков встречаются реже, причем, как правило, атакуется единственный сегмент тела.
Но первым симптомом, который на несколько дней опережает экзантему, сопутствует ей и сохраняется после ее исчезновения, является резкая боль по ходу нервов поражаемого кожного сегмента. Не исключено, что невралгии (особенно тройничного нерва) возникают и без кожных высыпаний, оставаясь этиологически не расшифрованными. Патогенез болевого синдрома не ясен. Можно думать, что в воспалительный процесс вовлекаются корешковые ганглии и даже задние рога спинного мозга, но нельзя забывать и о раздражении периферических нервных окончаний, тем более что при зостере (в отличие от ветряной оспы и простого герпеса) в везикулах много нейтрофилов, знаменующих обострение процесса.
Обычный исход опоясывающего герпеса — клиническое выздоровление, повторение заболевания является необычным. Процесс опасен лишь для больных с дефектами иммунитета (лимфопролиферативные заболевания, СПИД, химиотерапия по поводу злокачественых опухолей). В подобных случаях возможна генерализация процесса с поражением внутренних органов, нервной системы и высокой летальностью, тем более что эффективность антигерпетических препаратов при данной патологии оставляет желать лучшего. Больные не опасны для лиц, перенесших ветряную оспу, но могут заразить тех, кто еще не сталкивался с вирусом.
Живая аттенуированная вакцина обеспечивает великолепную защиту от ветряной оспы, но не гарантирует ее от опоясывающего герпеса.
Цитомегаловирус
Название цитомегаловируса (ЦМВ) отражает морфологию его цитопатического эффекта. В очагах поражения выявляются клетки больших размеров (25—40 мкм; греч. megas — гигантский) с крупными внутриядерными включениями, отграниченными от ядерной мембраны бледным, не воспринимающим окраску ободком (рис. 12).
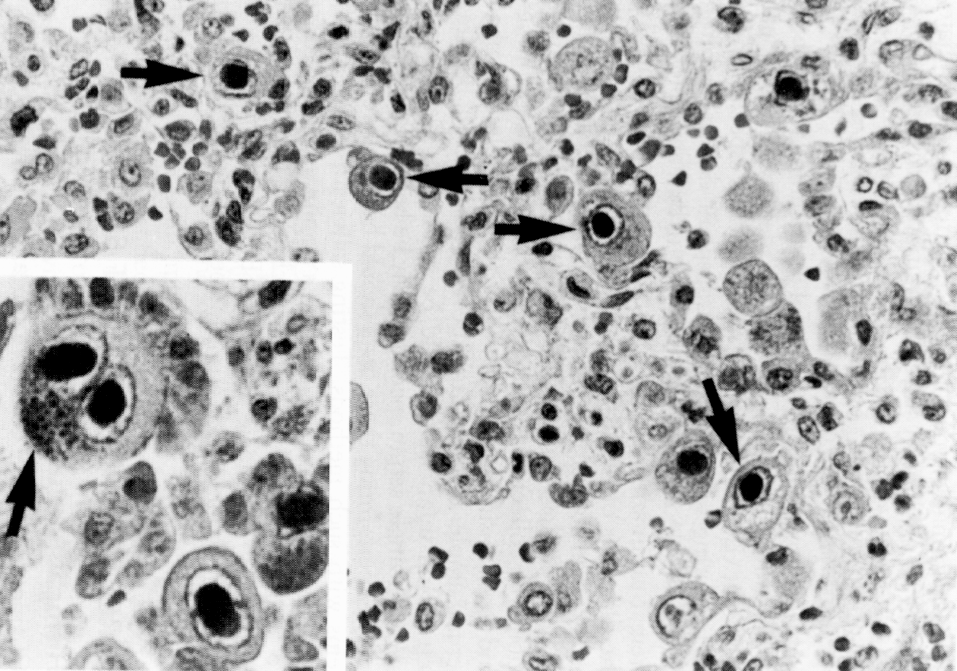
Такого рода клетки (их образно сравнивают с совиным глазом) впервые обнаружены в 1904 г. в почках, легких и печени новорожденных с диагнозом «врожденный сифилис». Позже (1921—1926 гг.) был предложен термин «цитомегалия» и высказано предположение о ее вирусной природе. Так как цитомегалические клетки часто находили в аутопсийных слюнных железах, гипотетический вирус долго фигурировал как «вирус слюнных желез». Современное название появилось в конце 1950-х гг. после того, как ЦМВ научились культивировать в фибробластах человека. Сходные вирусы обнаружены и у животных — обезьян, мышей, морских свинок и др. Человек не чувствителен к чужим ЦМВ, а его собственный вирус (который достаточно неоднороден, но тем не менее создает межштаммовый иммунитет) размножается только в культуре человеческих фибробластов. Удивительно, но эпителиальные клетки, которые поражаются в организме, устойчивы к вирусу in vitro. Впрочем, фибробласты тоже довольно неохотно поддерживают репликацию ЦМВ, и цитопатический эффект в их культурах заметен не ранее 30—50 дней. Вирус прочно связан с клетками и лишь в небольшом количестве сбрасывается в культуральную среду. Поэтому заражение новой порции клеток лучше всего удается путем прямого контакта (сокультивирования) с зараженными клетками.
Считается, что к пятидесятилетнему возрасту инфицируются 75%, а по некоторым данным, почти 100% людей. В отличие от других герпесвирусов, этот показатель повышается медленно, примерно с 1%-ным ежегодным приростом. Гораздо быстрее контаминируются новорожденные: к концу первого года жизни 5—10% детей обретают серопозитивность. Заражение происходит в родовом канале, при грудном вскармливании или через слюну. Но это может случиться и раньше: обладая склонностью к трансплацентарной передаче, ЦМВ инфицирует 0,3—2,4% плодов. В дальнейшем главным источником вируса служит слюна, но так как он содержится и в других биологических жидкостях (моча, цервикальный и вагинальный секреты, сперма, кровь, пищеварительные секреты), пути заражения могут быть разными: воздушно-капельный, половой, парентеральный. С развитием трансплантологии реальным стало заражение ЦМВ при пересадке органов, особенно почек. Это опасно для серонегативных реципиентов, не имевших ранее контактов с ЦМВ.
Подобно всем герпесвирусам, для ЦМВ характерно длительное (часто пожизненное) пребывание в организме (рис. 13). Главным резервуаром служат мононуклеарные фагоциты (моноциты, макрофаги). Вирус содержится и в нейтрофилах, но, учитывая их короткую жизнь, они вряд ли способны поддерживать персистентную инфекцию. Следует скорее задуматься над вероятностью скрытого заражения костно-мозговых предшественников с поэтапным (при миелопоэзе) переходом вируса в зрелые лейкоциты. Наконец, ЦМВ определяется в эпителиоцитах слюнных желез, почечных канальцев, выводных протоков поджелудочной железы, в гепатоцитах и других тканях. Присутствие в них ЦМВ не всегда отвечает критерию инертной персистенции, так как, подвергаясь репликации, вирус не только сбрасывается в окружающую среду, но и вызывает ограниченные поражения, которые регистрируются по появлению цитомегалических клеток.

Клинически ЦМВ впервые заявил о себе как возбудитель патологии плода и новорожденных. Внутриутробное инфицирование обычно проходит незаметно и ничем не обнаруживает себя при рождении. Но в 5% случаев (чаще при заражении в двух первых триместрах беременности) развивается цитомегалическая болезнь — острая форма инфекции с поражением внутренних органов. Характерны дефекты развития плода, гепатит и гепатоспленомегалия, тромбоцитопеническая пурпура (геморрагический синдром), гидро- и микроцефалия, хориоретинит. Это ведет к снижению интеллекта, локомоторным расстройствам, потере зрения. Прогноз всегда суровый, вплоть до мертворождения. Но и отсутствие клинических симптомов к моменту родов не означает полного подавления внутриутробной инфекции. В 15% случаев процесс получает медленную, но опасную эволюцию. Новорожденные отстают в умственном развитии и теряют слух из-за поражения сенсорных центров слухового нерва.
Необходимым условием для трансплацентарной передачи ЦМВ является вирусемия беременных. Ее причиной может быть реактивация латентного вируса (вторичная инфекция) или заражение женщин, не имевших ранее контакта с ЦМВ (первичная инфекция). Второй вариант более опасен. Дело в том, что если в первом случае плод одновременно с вирусом получает нейтрализующие антитела, то первично инфицируемые женщины серонегативны, а потому не готовы к экстренной защите плода от ЦМВ. Сегодня есть возможности для выявления антител (IgM, IgG) против ЦМВ. Это необходимо, чтобы решить вопрос об иммунологическом статусе беременных женщин и тем самым определить степень риска первичного заражения цитомегаловирусами. Предложены системы для поиска ЦМВ-антигенов и ПЦР с целью выявления ЦМВ-ДНК. Все это снижает опасность инфицирования плода, хотя и не гарантирует полной защиты от заражения — эндогенного или экзогенного.