Содержание
Стратегия резистентности базируется на следующих механизмах:
- снижение проницаемости клеточной стенки для антимикробного агента и подавление его транспорта к внутриклеточным мишеням;
- ускоренное выделение агента из клетки;
- модификация мишеней;
- снижение физиологической значимости мишени за счет дублирования способов образования жизненно важных метаболитов;
- конкурентное связывание (перехват) антимикробного агента;
- инактивация агента.
Сначала очень кратко остановимся на генетическом аппарате прокариот. Он представлен единственной хромосомой, где находится большинство (около 3000) генов, и миниатюрными ДНК-молекулами — плазмидами. Самые крупные из них включают не более 200 генов, но тем не менее очень важны для своих хозяев. Это прежде всего связано с тем, что плазмиды несут гены адаптации, которые повышают экологическую пластичность бактерий, позволяя приспосабливаться к необычным условиям и выживать в экстремальных ситуациях. Многие из таких генов относятся к транспозонам — подвижным (прыгающим) генам. Они охотно переходят из репликона в репликон (например, из плазмиды в плазмиду, из хромосомы в плазмиду и т.д.) и вкупе с мобильностью самих плазмид обеспечивают быстрое распространение генов внутри популяций, видов и даже между разными видами бактерий.
Резистентность бывает первичной и приобретенной, т.е. предсуществует до встречи с антимикробным агентом или возникает после взаимодействия с ним. Первичная резистентность закодирована в хромосомных генах и является видовым признаком. Например, грамотрицательные бактерии (за исключением нейссерий) малочувствительны к природным пенициллинам, так как они плохо проникают через их наружную мембрану. У синегнойной палочки этому способствует барьер из слизи, непроницаемой для многих агентов. Бактерии могут быть лишены мишени, атакуемой антибиотиком, или факторов, которые обеспечивают их активацию. Так, микоплазмы не имеют клеточной стенки и поэтому не чувствительны к бета-лактамам. Обладая высокой активностью против аэробов и факультативных анаэробов, аминогликозиды не действуют на анаэробные бактерии, которые лишены транспортных систем, необходимых для ассимиляции аминогликозидных антибиотиков. Напротив, метронидазол эффективен против облигатных анаэробов, но бессилен против аэробных бактерий. Дело в том, что для активации метронидазола требуется восстановление его нитрогруппы, а такой способностью обладают только анаэробы.
Приобретенная (вторичная) резистентность непредсказуема, а потому доставляет особенно много хлопот. Ее основным механизмом является приобретение генов резистентности (r-генов), переносимых транспозонами и плазмидами. Плазмида, содержащая r-гены, называется R-плазмидой, или R-фактором. R-плазмиды могут иметь единственный r-ген или быть носителем r-генов к нескольким антибиотикам. Полирезистентность возникает и в том случае, если бактериальная клетка содержит несколько разных R-плазмид.
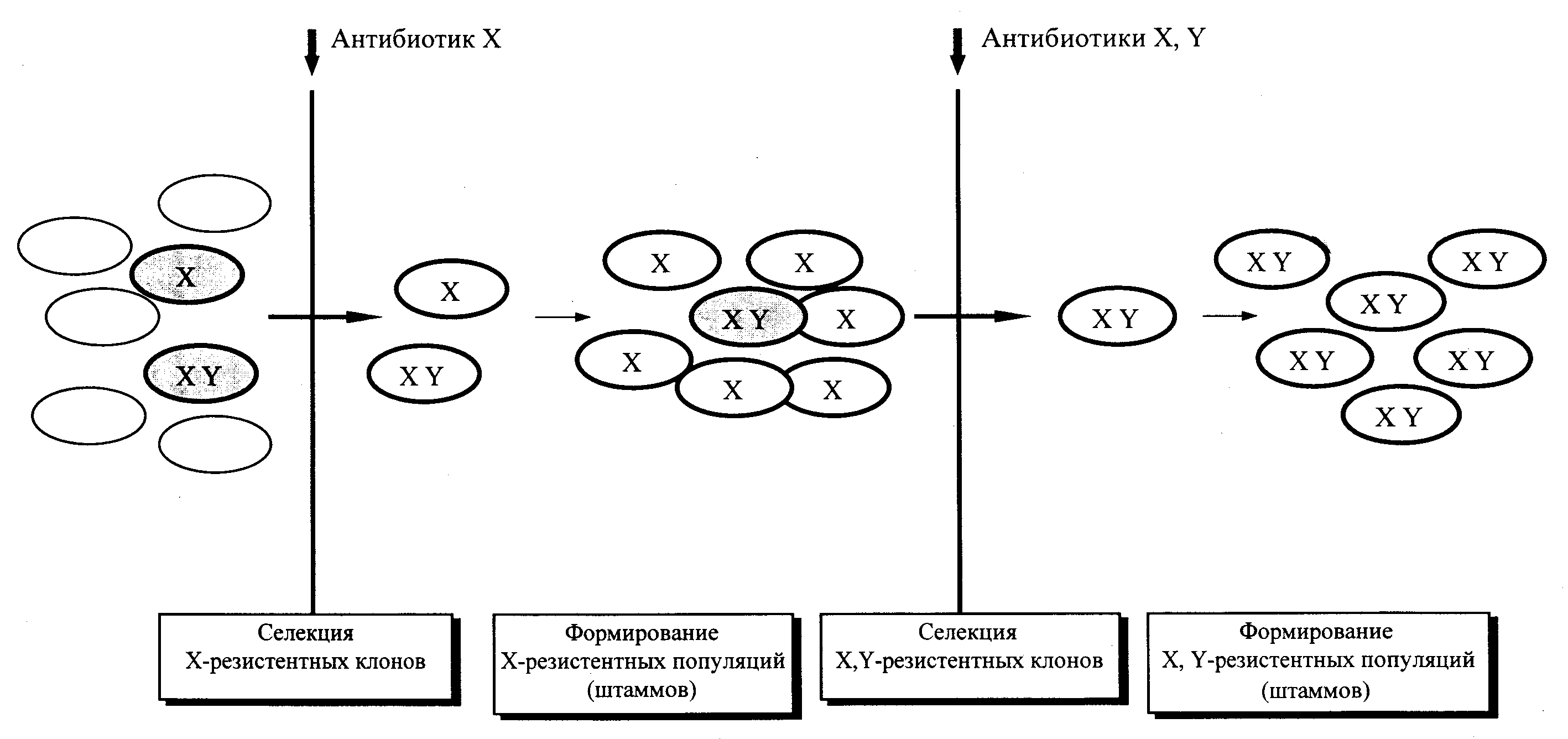
Важно понимать, что антибиотики не индуцируют образование r-генов, а лишь способствуют их отбору. Такие гены обнаружены у штаммов, которые были законсервированы задолго до внедрения антибиотиков, а также у изолятов из регионов, где данный антибиотик никогда не применялся. В подобных случаях r-гены обнаруживаются в единичных бактериях (точнее клонах), так как, не создавая преимуществ своим обладателям, не получают распространения. Антибиотик действует как селекционирующий фактор. В его присутствии выживают лишь резистентные клоны, из которых формируется устойчивая популяция — вплоть до устойчивого вида, как это случилось для пенициллинрезистентных стафилококков (резистентностью к природным пенициллинам обладают 90—98% циркулирующих штаммов S. aureus) (рис. 11).
Бета-лактамные антибиотики. Яркой иллюстрацией к проблеме лекарственной устойчивости бактерий и борьбы с ней является история бета-лактамных антибиотиков — пенициллинов и цефалоспоринов. Эта борьба проходила и продолжается в двух направлениях — химическая модификация природных антибиотиков (получение более активных и устойчивых производных) и нейтрализация бета-лактамаз — самого важного фактора приобретенной бета-лактамной резистентности бактерий.
Природные пенициллины не действуют на большинство грамотрицательных бактерий и чувствительны к бета-лактамазам. Путем замены в пенициллановой кислоте бензильного кольца на другие радикалы были получены пенициллины новых поколений, отличающиеся друг от друга по антибактериальным спектрам, устойчивости к пенициллиназам и фармакологическим свойствам. В частности, удалось получить препараты, проникающие в грамотрицательные бактерии, значительно расширив спектр антибактериальной активности природного пенициллина. К таким антибиотикам относятся аминопенициллины, карбоксипенициллины и позже полученные уреидопенициллины (см. таблицу). Это производные ампициллина, в которых присутствие боковой цепи, связанной с аминогруппой на альфа-углероде, обеспечивает повышенную способность соединяться с пенициллинсвязывающими белками (транспептидазами) и ускоренное проникновение в грамотрицательные бактерии через поры в наружной мембране. Синтезирована и группа пенициллиназорезистентных пенициллинов, которые активны против бактерий, продуцирующих бета-лактамазы, прежде всего против пенициллиназопозитивных стафилококков.
Показательна и эволюция цефалоспоринов. Их изучение началось в 1945 г. после открытия антибактериальной активности секреторных продуктов гриба Cephalosporium, а клиническое применение началось с 1965 г. По сравнению с пенициллином, родоначальник современных цефалоспоринов более устойчив к инактивирующим ферментам, но менее активен. Добавление новых боковых цепей позволило получить цефалоспорины трех поколений. В цефалоспоринах 3-го поколения усилен ряд преимуществ, заложенных в препаратах 2-го поколения: они активны против синегнойной палочки и палочки инфлюэнцы, обладают повышенной устойчивостью к бета-лактамазам и хорошо проникают в центральную нервную систему. Последнее обстоятельство сделало их полезными при лечении грамотрицательного менингита. Однако не следует думать, что очередное поколение автоматически обесценивает предыдущие. Например, цефалоспорины 1-го поколения эффективны против грамположительных бактерий, тогда как препараты 2-го и 3-го поколений нацелены преимущественно на грамотрицательные бактерии. Поэтому иногда говорят не о поколениях, а о группах цефалоспоринов, отмечая микробиологические и фармакодинамические особенности (достоинства и недостатки) каждой из них.
Еще раз повторим, что вторичная устойчивость бактерий против пенициллинов и цефалоспоринов связана с плазмидозависимой (гораздо реже с хромосомной) продукцией бета-лактамаз — ферментов, которые разрушают активный центр бета-лактамных антибиотиков (рис. 12).
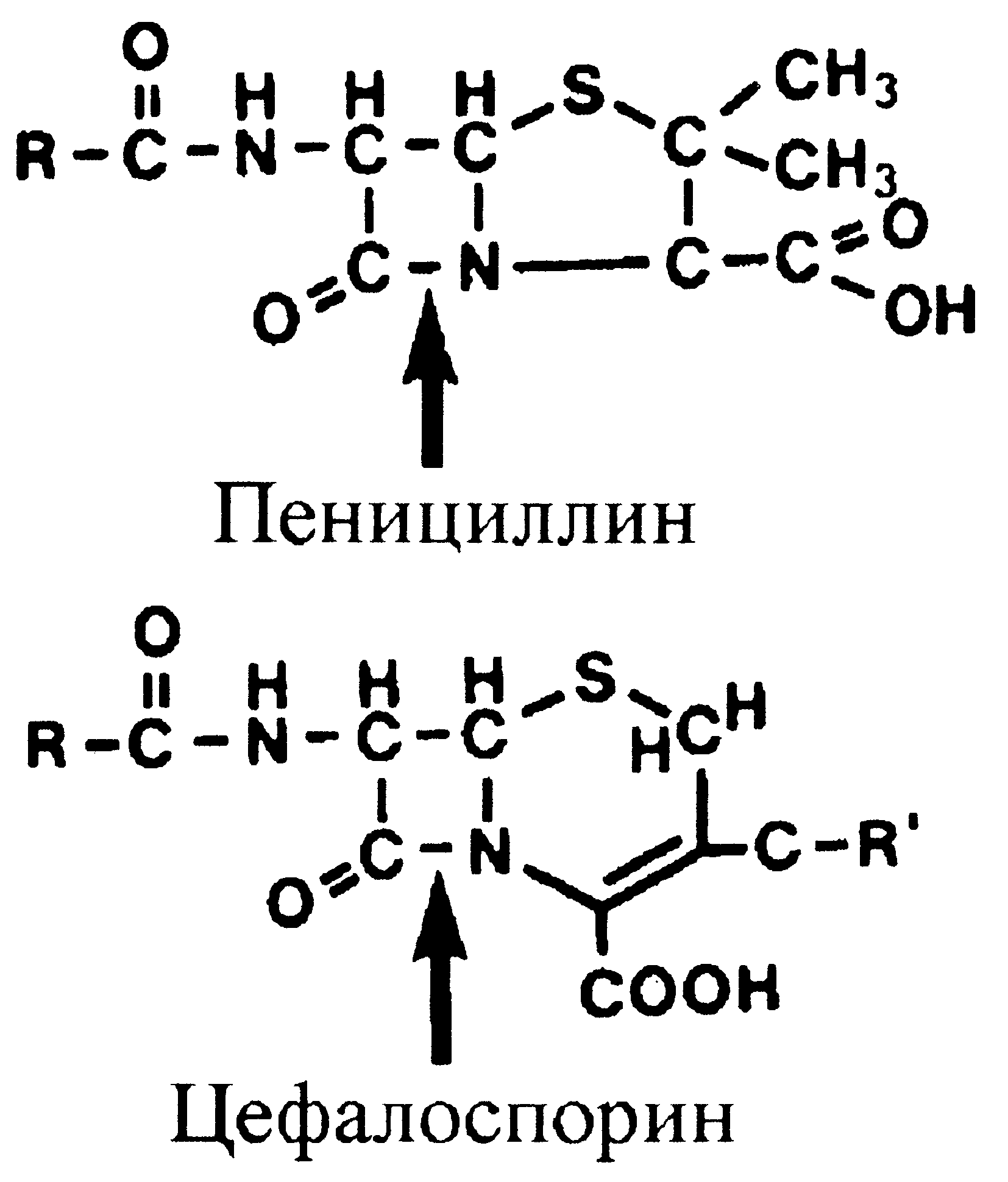
Известно более 100 бета-лактамаз, но далеко не все из них причастны к клинически значимой резистентности бактерий. Различают два вида бета-лактамаз — пенициллиназы и цефалоспориназы, что довольно условно, так как и те и другие атакуют обе группы антибиотиков, хотя и с разной эффективностью. Грамположительные бактерии (например, стафилококк) обычно продуцируют внеклеточные бета-лактамазы, которые разрушают препараты до контакта с бактериями. Они относятся к категории индуцибельных ферментов, причем в качестве индуктора нередко выступают сами антибиотики. В таких случаях повышение дозировки не усиливает антибактериального эффекта, так как ведет к гиперпродукции инактивирующего фермента. У грамотрицательных бактерий бета-лактамазы концентрируются в периплазме или связаны с плазматической мембраной. Они часто конститутивны, т.е. продуцируются на постоянном уровне, который не меняется под влиянием антибиотика. Поэтому повышение дозировки иногда помогает преодолеть резистентность. Можно, например, вспомнить о лечении гонореи: поначалу гонококк демонстрировал поразительную чувствительность к бензилпенициллину, но на протяжении последних 30 лет его дозировку приходилось постоянно увеличивать.