Содержание
Болезнетворность вирусов
- Эволюция болезнетворности.
- Деструкция клеток.
- Образование симпласта.
- Апоптоз.
- Онкогенная трансформация.
- Иммунопатогенез вирусных инфекций.
- Персистенция.
- Медленные инфекции и прионы.
Вирусная инфекция эволюционирует на уровне чувствительных (пермиссивных) клеток, куда вирус вносит свои гены. От их экспрессии зависят судьба клетки, вируса и клинические проявления инфекционного процесса. Селекция поражаемых клеток начинается с распознавания клеточных рецепторов, комплементарных адгезивным белкам вириона. Это означает, что каждый вирус находит собственную молекулярную мишень, которая выводит его на определенную категорию пермиссивных клеток. Некоторые (возможно, многие) вирусы распознают несколько мембранных структур, и связывание представляет собой многоступенчатый (в том числе с функциональной точки зрения) процесс (см. «ВИЧ-вирусы»). После проникновения в клетку вирус (точнее, вирион) распадается на субкомпоненты с высвобождением геномной молекулы (ДНК или РНК). Она определяет дальнейшую стратегию вируса — репродукцию новых вирусных частиц (продуктивная, или репликативная инфекция) или персистенцию с более или менее ограниченной экспрессией вирусных генов (вирогения). И то и другое чревато повреждением клеток — цитопатическим эффектом.
Повреждение означает комплекс структурно-функциональных нарушений, которые заканчиваются гибелью клетки или (если они обратимы) допускают восстановление. Иными словами, подвергаясь вирусной атаке, клетки, подобно организму, начинают болеть, причем исходы этой болезни могут быть разными — гибель, выздоровление, уродства. К уродствам, например, относятся опухолевая (онкогенная) трансформация клеток и образование поликарионов в результате слияния нескольких клеток. Но изменения не всегда столь очевидны. Они могут ограничиться появлением на поверхности зараженных клеток новых (вирусных) антигенов, в том числе в комплексе с HLA. Впрочем, и такая перестройка может быть значимой, превращая клетку в мишень для иммунных реакций. На этом основано выделение двух механизмов вирусной цитопатогенности — прямые и опосредованные эффекты. Первые целиком зависят от самого вируса. Они отражают его взаимоотношения с клетками и могут быть воспроизведены в инвитровых культурах, т.е. вне организма. Вторые требуют участия эффекторов иммунитета и проявляются на уровне организма.
Эволюция болезнетворности
Последние годы преподнесли немало микробиологических сюрпризов, одним из которых явилось осознание того, что мы еще плохо знаем мир микробов и те опасности, которыми они угрожают человеку. Появились два англоязычных термина, emergent и reemergent infections, которые можно перевести как новые и возрождающиеся инфекции. Среди них есть заболевания вирусной природы — глобального (ВИЧ-инфекция, гепатит С) и регионального (природно-очаговые зоонозы) масштаба. Но большинство такого рода инфекций не являются новыми. Их возбудителями служат давно сформировавшиеся вирусы, с которыми люди до недавних пор встречались редко. В основе современных вспышек лежат экологические причины, связанные с активным внедрением человека в природу, когда ему приходится сталкиваться с естественными резервуарами новых для себя вирусов, таких как арбовирусы (англ. arthropod-born viruses — вирусы, передающиеся членистоногими) и родентвирусы (англ. rodent-born viruses — вирусы, передающиеся от грызунов). Имеет значение и попадание неиммунных лиц в эндемичные зоны, где благодаря широкой циркуляции возбудителя у местного населения поддерживается приобретенный иммунитет.
Вирусы подвержены генетическим изменениям на основе мутаций и рекомбинаций. Особенно быстро меняются некоторые РНК-вирусы. Это связано с тем, что клетки не контролируют точность операций, совершаемых РНК-полимеразами, как это делается в случае ДНК-полимераз. У ретровирусов к этому добавляются ошибки обратной транскриптазы, многократно усиливающие мутагенез. Подсчитано, например, что шестилетняя персистенция ВИЧ-1 в организме дает начало такому количеству вариантов, какое в течение данного времени способна обеспечить многомиллионная эпидемия гриппа А.
Большинство мутаций летальны (т.е. ведут к появлению нежизнеспособных фенотипов), но возможны и потенциально полезные перестройки, создающие прецедент для эволюции, в том числе для повышенной вирулентности в пермиссивных системах. Это зависит от естественного отбора на уровне инфицированной клетки и организма, а также при передислокации (трансмиссии) вируса очередному хозяину.
Вирусы являются результатом длительной коэволюции со своими естественными хозяевами. Переход в новую обстановку невыгоден и может обернуться катастрофой для вируса и его нового хозяина. Именно так обстоит дело с большинством зоонозных вирусов, для которых человек является экологическим тупиком. Требуется стечение многих обстоятельств, чтобы селекция в подобных условиях закончилась удачно для вируса. Очевидно, это должен быть генетический вариант с принципиально новыми свойствами, которые способны инициировать новую стратегию, предусматривающую не только внутривидовые вариации, но и видообразование. Это требует времени, которое даже у столь быстро размножающихся и мутирующих организмов, как вирусы и бактерии, несопоставимо длиннее человеческой жизни. Поэтому вирусы, которые сегодня воспринимаются как новые, в лучшем случае являются обновленными.
Одним из немногих примеров среди современных вирусов, претендующих на новый (видовой) таксономический ранг, является вирус иммунодефицита, ВИЧ-1. Его следы уходят в Африку, в 1950-е гг. Именно в это время в сыворотках аборигенов стали фиксироваться анти-ВИЧ-антитела. Тогда это была эндемичная инфекция (нечто похожее на нынешний ВИЧ-2), и причины, которые вывели ее на глобальный уровень, точно неизвестны. Скорее всего, они связаны с рекомбинантными клонами, которые возникли при инфицировании человека обезьяньим (шимпанзе) вирусом иммунодефицита. Именно от него берет начало современная генеалогия ВИЧ-1.
Внешние проявления и механизмы цитопатического эффекта
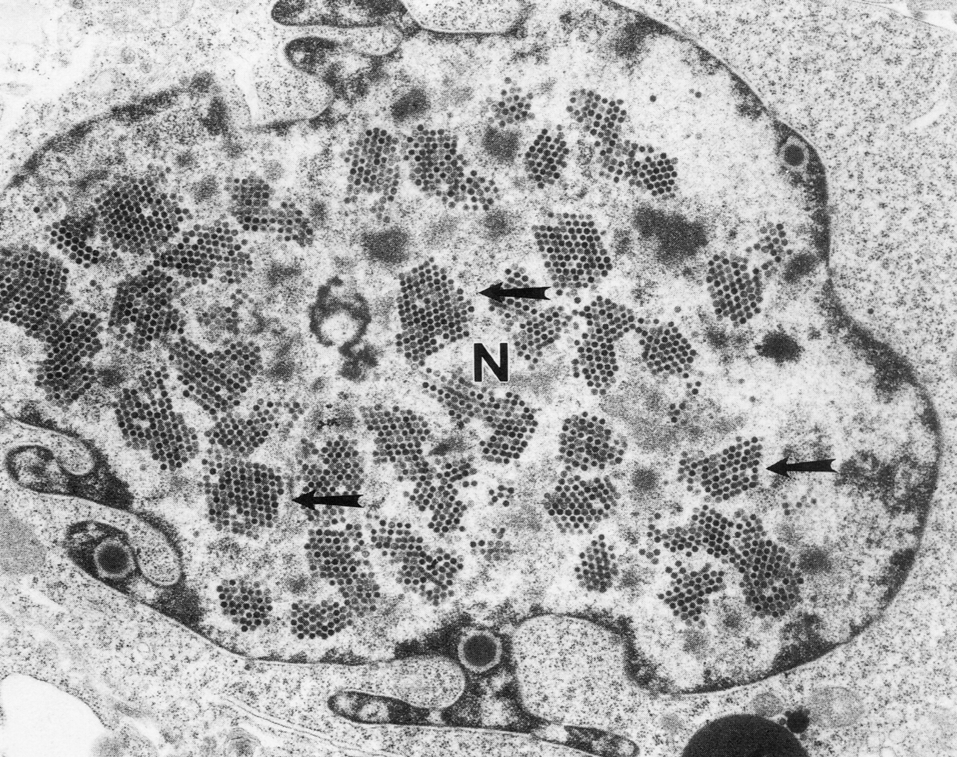
Цитолиз (некроз). В его основе лежит повышение проницаемости плазматической мембраны. Открывая доступ Са2+, это ведет к внутриклеточному ионному дисбалансу, пассивному вхождению воды, разбуханию клетки, разрыву мембраны и вытеканию цитоплазмы. В клеточных культурах этому соответствуют зоны так называемых негативных колоний — бляшек (рис. 1). Гибели клеток предшествует появление цитоплазматических или ядерных включений, которые возникают в местах сборки вирусных нуклеокапсидов и иногда заметны под микроскопом (рис. 2).

Формально цитолиз можно представить как взрыв изнутри, когда плазматическая мембрана лопается под напором вирусных частиц, скапливающихся в клетке. Высвобождение оболочечных (сложных) вирусов происходит путем почкования. В этом случае вирусный нуклеокапсид покрывается наружной оболочкой (суперкапсидом), отбирая у клетки фрагмент модифицированной мембраны. Здесь возможен феномен решета: при множественном почковании клетка не успевает ликвидировать «дыры» в мембране и предупредить вытекание цитоплазмы. Допускается и вероятность аутолиза в связи с повреждением лизосом и высвобождением из них деструктивных ферментов.
Но все это выглядит слишком прямолинейно. Клетке отдается роль пассивного полигона, где вирус беспрепятственно воспроизводит свое потомство, не встречая сопротивления. События, которые предшествуют и, возможно, способствуют цитолизу, остаются за кадром. Между тем, количество зрелых вирионов, накапливающихся в клетках, не всегда коррелирует с литическим эффектом. Известны примеры, когда клетка гибнет, не дождавшись гиперпродукции вируса. Это означает, что должны быть иные (возможно, главные) причины цитолиза, связанные с более тонким вмешательством вируса в жизнь клетки.
Вирусная инфекция — яркий пример молекулярной патологии, которая формируется под влиянием конкурентного вмешательства вирусных белков в жизненно важные процессы клетки. Жить — значит непрерывно обновлять свои функциональные и структурные элементы. Клетка, лишенная такой возможности, погибает.
Отсюда наиболее общим условием цитопатического эффекта следует считать подавление обновляющего синтеза макромолекул, стабилизирующих клеточный гомеостаз. Вирусологи называют это дискриминацией, подразумевая, что вирус вынуждает клетку переключиться на синтез своих нуклеиновых кислот и белков; самообновление клетки прекращается или задерживается. За этим скрывается множество механизмов, большинство из которых не раскрыты, хотя ряд примеров убеждает в их удивительной изящности. Так, вирус полиомиелита блокирует белок, необходимый для взаимодействия клеточных мРНК с рибосомами (кэп-связывающий белок); полиовирусная мРНК не нуждается в этой реакции, получая возможность для селективной трансляции. Действие вируса бешенства на нейроны определяется поверхностным гликопротеином G. Секвенирование (анализ нуклеотидной последовательности) клонированного гена G двух аттенуированных авирулентных штаммов показало, что лишение вируса нейротропности связано с заменой единственной аминокислоты в одном из участков гликопротеина G. Не ясно, чем обусловлен механизм аттенуации (нарушением связывания вируса нейронами или особенностями вирусной репликации), но это говорит о высокой специфичности факторов, вовлекаемых во взаимодействие вируса и клетки. Одной из универсальных мишеней для вирусов являются клеточные тирозин-протеинкиназы. Благодаря сопряжению с ключевыми звеньями метаболизма их экранирование вирусными белками не только подавляет важнейшие функции клеток, но и возбуждает реакции, обслуживающие вирусную репликацию.