Содержание
Блокада NF-kB и противовоспалительная терапия. Многообразие медиаторных путей, возбуждающих NF-kB, показывает новые направления регуляции иммунных и воспалительных реакций. Главным является сам фактор NF-kB и его ингибиторы, IkB и IKK.
Перемещение NF-kB в ядро блокируется дитиокарбаматом пирролидина (ингибитор окислительного стресса) и глиотоксином (препарат из аспергилл). Блокаду активации NF-kB вызывают факторы, подавляющие серин-фосфорилирование, убиквитинизацию и протеасомный протеолиз IkB. Важно, что все они не влияют на способность белков IkB к комплексообразованию с NF-kB. Каскад реакций можно прервать и при помощи торможения IKK. Это задерживает активирующее разобщение комплекса NF-kB—IkB.
Для ингибиции NF-kB могут быть использованы генетические подходы — применение антисмысловых олигонуклеотидов; фрагментов ДНК, гомологичных NF-kB (decoy-факторов); IkB-cуперрепрессора, не поддающегося негативному фосфорилированию (IkB с двойной мутацией по серину 32 и 36). Следует помнить и о блокаде протеинкиназ, занимающих положение выше IKK (MAKP-киназы, PKC и др.). Это подтверждает их участие в активации IKK, а также в индукции других (дополняющих эффекты NF-kB) транскрипторов.
Большинство опытов проведено в клеточных культурах, но ряд наблюдений выполнен на животных. Примером служит подавление неспецифического и аутоиммунного воспаления при введении дитиокарбамата пиролидина, глиотоксина, NF-kB-decoy-ДНК-фрагментов, IkB-суперрепрессора или протеасомных ингибиторов. Все это пока не нашло практического применения или внедряется с осторожностью. Заметно опасение перед условной специфичностью большинства ингибиторов. Не ясно и то, что может случиться при длительном выключении NF-kB, если учесть его значимость для таких важных процессов, как пролиферация и апоптоз.
Тем не менее уже сегодня медицина использует ряд средств, действующих (по крайней мере частично) через торможение NF-kB. Так ведут себя глюкокортикоиды, которые прямо или косвенно блокируют активацию NF-kB. Из нестероидных препаратов следует отметить противовоспалительный эффект «малых» молекул, таких как аспирин, сульфасалазин, лефланомид и др. Их эффект ранее связывали исключительно с подавлением индуктивной циклооксигеназы-2 и синтеза противовоспалительных простагландинов. Но оказалось, что они активны и за счет блокирующего действия в системе NF-kB, в частности из-за подавления IkB-фосфорилирования.
Большой интерес вызывают ингибиторы деструктивной функции протеасом. Они обладают антионкогенным и противовоспалительным эффектами и направлены против активации NF-kB. С этой целью используют пептиды из группы борной кислоты типа PS-341 и PS-519. Такое же действие оказывают блокаторы убиквитиновой лигазы, переводящей IkB в объект для протеасомного протеолиза.
Ингибицию NF-kB могут вызывать и естественные продукты. Примером является куркумин — препарат из ризом Curcuma longa, растения южной и юго-восточной Азии. Куркумин (диферулоилметан) подавляет разрушение IkB, блокируя активацию IKK. Не случайно им давно пользуются как антивоспалительным средством в странах, где он производится в качестве вкусовой добавки. Интересный феномен обнаружен при изучении непатогенных кишечных бактерий. Авирулентные сальмонеллы и бактероиды при колонизации интестинальных эпителиоцитов подавляют убиквитинизацию IkB, снижая NF-kB-зависимое выделение цитокинов (похожее действие оказывает Saccharomyces boulardii, блокирующий сигнальные каналы МАРК). Лактобациллы, рекомендованные как пробиотик, выделяют факторы, вызывающие быстрый антипротеасомный эффект интестинальных эпителиоцитов, блокируя деструкцию ингибиторных факторов IkB. Все это позволяет говорить об участии NF-kB во взаимоотношениях эпителиальных клеток с нормальной микрофлорой и о возможности использования данного феномена в лечебных и профилактических целях.
* * *
Перечитывая И.И. Мечникова, удивляешься, насколько ясно ему представлялось будущее своей теории, в том числе ее прикладные аспекты. Многие из современных идей, связанных с регуляцией воспалительных реакций, были заложены И.И. Мечниковым и его ближайшими последователями. Эту преемственность не всегда просто разглядеть за изобилием фактов, новых терминов и изощренных методов. Но лозунг И.И. Мечникова «нет воспаления без фагоцитов», который (помня о диалектике воспалительных реакций) можно видоизменить: «Нет здоровья и болезней без воспаления и фагоцитов» — остается одним из главных направлений в борьбе за гомеостаз.
Апоптоз
Жить — значит умирать. Ф. Энгельс Ад и рай — две половины души.
О. Хайям
- Генетически запрограммированная смерть клеток.
- Альтернатива некротическому цитолизу.
- Индукция, регуляция и эффекторы апоптоза.
- Гомеостаз и патология.
- Взаимоотношения с инфекционными агентами.
Несмотря на непрерывное обновление, количество клеток в тканях взрослого организма остается постоянным. Это означает, что число вновь образующихся клеток соответствует числу отмирающих. Процесс физиологического отмирания клеток совершается незаметно, не сопровождается воспалительными реакциями, которые расширяют масштаб повреждения при некрозе.
Естественная смерть является вполне логичным событием, как любое замещение старого новым. Возможно, по этой причине интерес к нему просыпался медленно и лишь недавно достиг уровня концептуальных обобщений. Физиологическую смерть клеток стали называть апоптозом — термином, которым древние греки обозначали опадание лепестков с цветка или листьев с деревьев (греч. apoptosis — отделение, удаление). Классический апоптоз — не единственный механизм нормальной гибели клеток, но, безусловно, один из ее главных рычагов.
Понятие «апоптоз» введено в биологию в 1972 г., когда J. Kerr, A. Wyllie и A. Currie предложили его для характеристики комплекса однотипных морфологических изменений, которые наблюдаются при отмирании клеток, не связанном с некрозом. В их исследованиях признаки апоптоза были обнаружены в краевых зонах ишемических поражений; центральная область подвергалась некрозу. Современный интерес к этому феномену возник позже, в конце 1980-х гг., после того как понятие апоптоза слилось с представлениями о запрограммированной смерти клеток, информация о которой закодирована в клеточном геноме и поддается фенотипической регуляции. Было осознано, что апоптоз — такая же фундаментальная генетическая программа, как пролиферация, дифференцировка или пребывание клеток в покоящемся состоянии. Об апоптозе говорят как об активной смерти (противопоставляя его некрозу, т.е. пассивной гибели от «несчастного случая»), как о самоубийстве клеток, сознательно выбирающих дорогу смерти, если они чувствуют собственную бесполезность, а тем более опасность для клеточного сообщества. Общепризнано, что апоптоз занимает ключевые позиции в физиологии эмбрионального морфогенеза, метаморфозе, элиминации (негативной селекции) аутореактивных Т-лимфоцитов, уничтожении опухолевых и вирусинфицированных клеток. Широко обсуждается его роль в патологии — при аутоиммунных заболеваниях, злокачественных опухолях, дегенеративных и атрофических процессах, инфекционной патологии.
Феноменология апоптоза
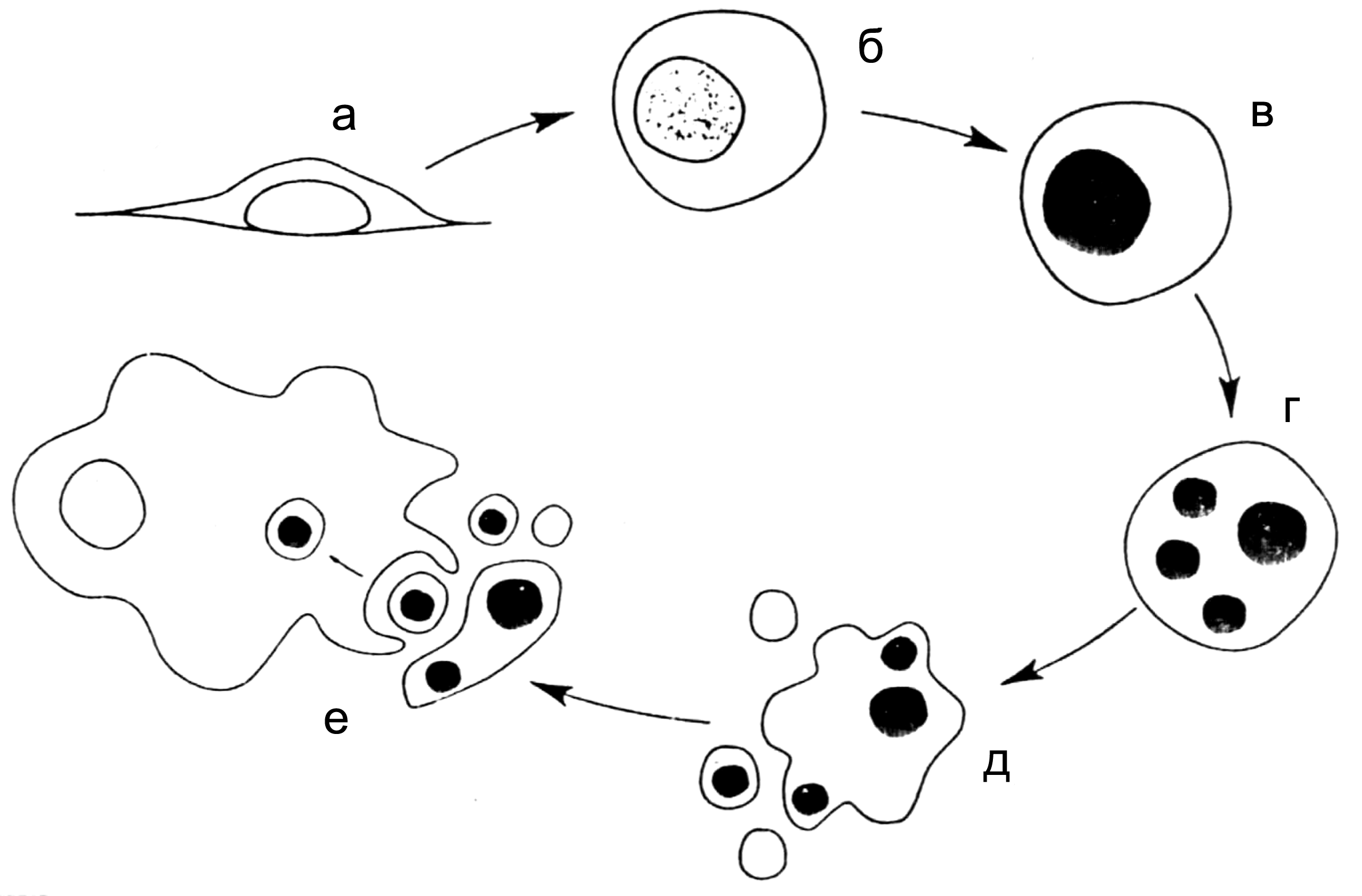
Клетки, вступившие на путь апоптоза, претерпевают стереотипные изменения, ведущие к формированию характерного фенотипа (рис. 1, 2). Принципиально, что гибель наступает при сохранении целостности плазматической мембраны и внутриклеточных органелл. Поэтому клетка не разбухает (результат повреждения мембраны и переполнения клетки водой из окружающей среды), как в случае некроза, а сжимается, конденсируя цитоплазму и оставаясь непроницаемой для красителей типа трипанового синего или пропидий йодида. Клетки округляются, теряя микроворсинки, рецепторы и структуры, обеспечивающие клеточные функции и межклеточные контакты. Их контур становится гладким, и они отделяются от соседних клеток.