Содержание
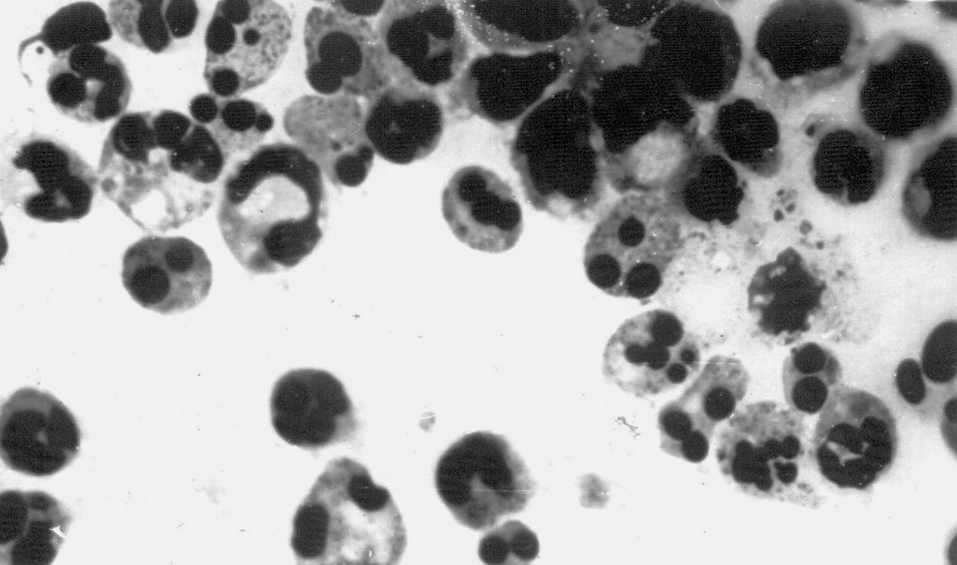
(препарат Н.А. Маянского)
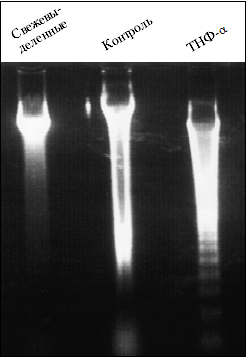
Одновременно или раньше ядерный хроматин подвергается агрегации и расщепляется активированными эндонуклеазами на нуклеосомальные фрагменты, которые при электрофорезе разделяются на дискретные фракции (ДНК-лестница; рис. 3) в отличие от сплошного пятна деградированной ДНК некротизированных клеток (результат беспорядочного разрушения хроматина экзонуклеазами).
Вслед за этими изменениями (они совершаются в считанные минуты) в мембране образуются выпячивания, которые отпочковываются от клетки в виде апоптозных тел. Последние, как и сама клетка, окружены уплотненной (ригидной) мембраной и могут содержать органеллы и фрагменты ядра. Апоптозные тела поглощаются мононуклеарными фагоцитами, а также сбрасываются в окружающую среду. Поглощенный материал переваривается лизосомальными ферментами, причем макрофаги уничтожают его, не подвергаясь активации. Весь процесс, от агрегации хроматина до полного переваривания апоптозных тел, занимает 1—3 ч. Этим скоротечным событиям предшествуют латентные сдвиги, которые развиваются на протяжении 10—12 ч. На этом этапе клетки могут быть спасены от апоптоза продуктами протективных (антиапоптозных) генов; финальные события не обратимы.
В целом морфологическая картина апоптоза отражает упорядоченность подключения механизмов, направленных на то, чтобы избежать взрывоопасных последствий цитолиза, когда из клетки высвобождается комплекс флогогенных начал, инициирующих воспалительную реакцию и сопряженные с ней вторичные повреждения. Однотипность цитопатических изменений позволяет думать об общности эффекторных механизмов апоптоза для любых клеток, по крайней мере на его заключительных этапах.
Методы регистрации апоптоза
Классический способ обнаружения апоптозных клеток основан на морфологических признаках, которые выявляются с помощью обычного светового микроскопа. Именно этот метод использовался для первого описания апоптозной гибели клеток и ее отделения от некроза. Клетки, вступившие на путь апоптоза, подвергаются характерным внешним изменениям (см. рис. 2): они уменьшаются в размерах (сморщиваются), ядерный хроматин уплотняется, ядро теряет свою структуру и распадается на несколько мелких образований (апоптозных тел). Подсчитав долю таких клеток в клеточной популяции, можно определить апоптоз количественно. Несмотря на свою простоту, морфологический метод достаточно трудоемок и субъективен. В настоящее время для исследования апоптоза имеется широкий набор других методик, хотя морфологический подход по-прежнему не утратил своего значения.
Для качественного определения апоптоза применяется электрофорез ДНК в агарозном геле. При анализе ДНК апоптозных клеток в геле регистрируется «апоптозная лестница» (см. рис. 3). Возникающая картина связана с тем, что при апоптозе ДНК расщепляется упорядоченно, т.е. между нуклеосомами (интернуклеосомное расщепление). Это ведет к накоплению наборов фрагментов ДНК, которые имеют разную электрофоретическую подвижность и формируют «лестницу». ДНК нормальных клеток в связи со своей большой массой остается в исходной точке, а при электрофорезе некротических клеток ДНК образует непрерывную полосу, отражающую беспорядочное расщепление и отсутствие наборов одинаковых фрагментов. Данный метод имеет сравнительно низкую чувствительность, но высокую специфичность.
При электрофорезе анализируется вся ДНК, экстрагированная из популяции клеток, что не позволяет проводить количественную оценку апоптоза. С этой целью используется другой метод, основанный на окрашивании ДНК с помощью пропидий йодида и последующем анализе на проточном цитофлюориметре. Пропидий йодид является специфическим красителем ДНК, так как при встраивании в молекулу двухцепочечной ДНК интенсивность его флюоресценции возрастает в 20 раз. Следовательно, свечение будет прямо коррелировать с содержанием ДНК в клетке. После обработки клеток гипотоническим раствором с добавлением детергента они набухают, и через дефекты в цитоплазматических мембранах могут выходить небольшие фрагменты ДНК, образовавшиеся при апоптозном расщеплении. При окрашивании пропидий йодидом такие клетки светятся менее ярко, так как имеют меньшее (гиподиплоидное) содержание ДНК по сравнению с нормальными клетками, в которых расщепление ДНК отсутствует (т.е. содержание ДНК — диплоидное). Этот метод прост в исполнении, достаточно чувствителен и специфичен.
При необходимости исследовать апоптоз в гистологических препаратах (in situ) применяется метод, также основанный на апоптозном расщеплении ДНК. Здесь используется то обстоятельство, что при апоптозном расщеплении ДНК образуется множество новых 3’-окончаний, к которым с помощью терминальной деоксинуклеотидилтрансферазы присоединяют меченые нуклеотиды (метод называется TUNEL от англ. TdT-mediated dUTP-nick end labelling). Несмотря на широкое применение ТUNEL-метода, его специфичность оспаривается. Имеются данные о том, что некротические и живые клетки во время репарации ДНК также окрашиваются положительно. В связи с этим были предложены дополнительные маркеры для исследования апоптоза in situ, например иммуногистохимическое окрашивание с помощью специфичных антител для выявления активных каспаз, в частности каспазы-3, которая активна только в апоптозных клетках. Вообще, активация каспаз служит важным признаком апоптоза и используется для его регистрации. Каспазная активность может быть определена количественно при расщеплении специфического субстрата каспаз. Эквивалентом активации каспаз служит появление в клетках их активных фрагментов, выявляемых путем иммуноблоттинга (англ. Western blotting) с антителами, специфичными для таких фрагментов.
При развитии апоптоза клетки изменяют свои поверхностные характеристики, экспрессируя мембранные структуры, которые отсутствуют у нормальных клеток. Наиболее популярным маркером служит фосфотидилсерин. Этот фосфолипид входит в состав внутреннего слоя клеточной мембраны и при апоптозе выныривает наружу, т.е. появляется во внешнем слое плазматической мембраны. Здесь он может быть выявлен с помощью белка аннексина-V, который в присутствии ионов Са2+ обладает высоким сродством к фосфотидилсерину. Клетки, меченые аннексином-V, конъюгированным с флюоресцентной меткой, анализируются с помощью проточного цитофлюориметра. Живые клетки не окрашиваются аннексином-V, тогда как взвесь апоптозных клеток будет аннексин-V-позитивной. Изменения в клеточной мембране относятся к ранним апоптозным событиям, поэтому этот метод может использоваться для изучения начальных проявлений апоптоза. К его преимуществам следует отнести возможность количественного определения уровня апоптоза, высокую чувствительность и специфичность.
Наиболее популярным методом оценки изменений биохимического профиля апоптозных клеток служит МТТ-метод, широко используемый для работы с опухолевыми клетками и оценки их выживаемости in vitro. Он основан на восстановлении красителя МТТ (3-[4,5-диметилтиазол-2-ил]-2,5-дифенилтетразолиумбромид) в лиловый продукт формазана под воздействием дегидрогеназ, активность которых в апоптозных клетках снижается. Реакция регистрируется колориметрически: чем больше живых клеток в культуре, тем больше будет образовываться формазана и больше меняться интенсивность окрашивания. Метод удобен для скрининга выживаемости клеток, поскольку может проводиться в микропланшетах с небольшим числом клеток. Однако следует подчеркнуть, что здесь определяется выживаемость клеток, и активность дегидрогеназ уменьшается не только в апоптозных, но и в некрозных клетках. Иными словами, не обязательно, чтобы «невыжившая» клетка погибла от апоптоза.