Содержание
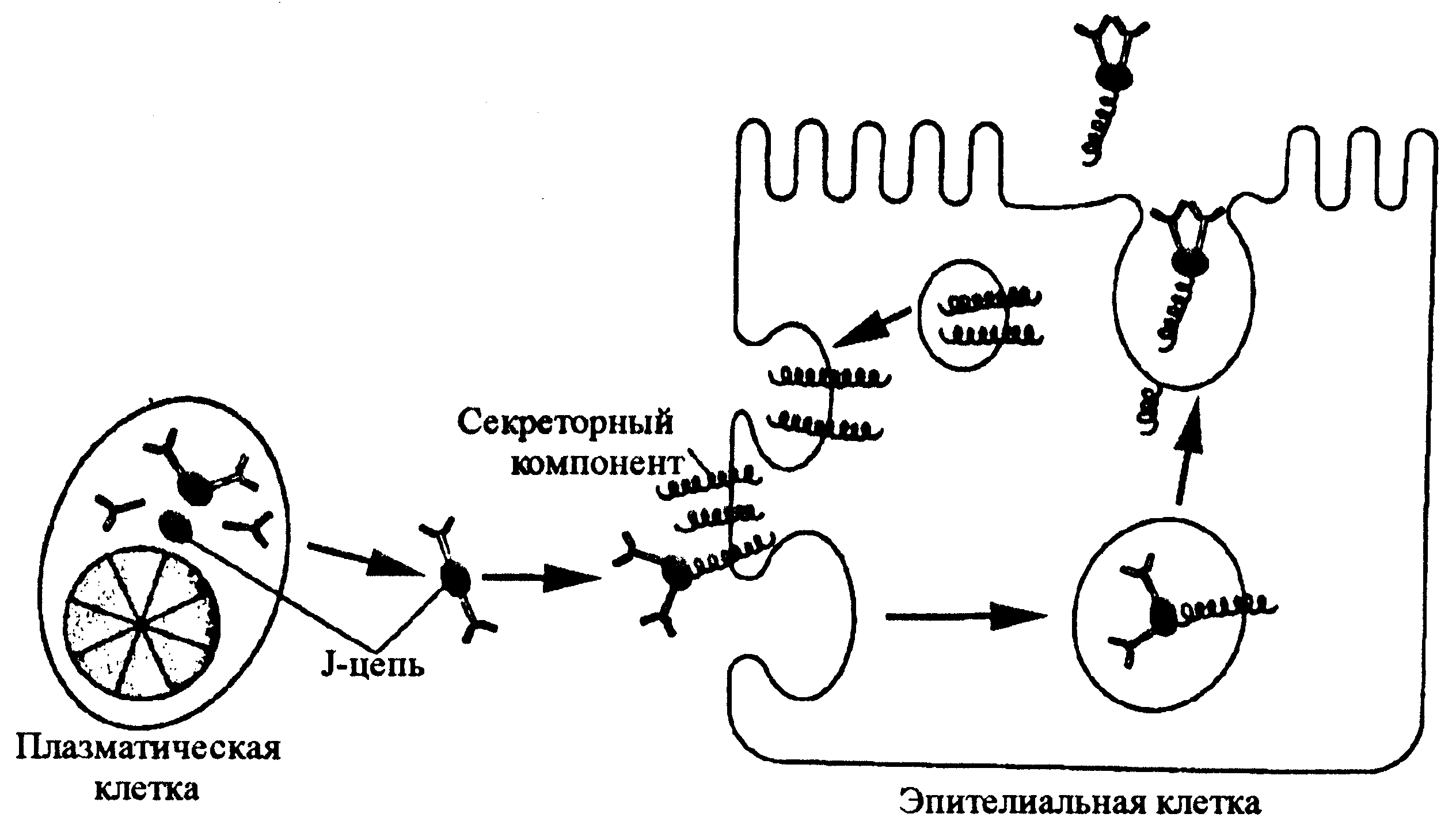
Базисная антиколонизационная активность секретов усиливается за счет антител, продуцируемых лимфоидной тканью слизистых оболочек. Они относятся к иммуноглобулинам класса A, которые транспортируются на поверхность слизистых оболочек при помощи секреторного компонента — особого белка, синтезируемого эпителиальными клетками (рис. 1). Некоторые бактерии (например, менингококки и гонококки) продуцируют специфические IgA-протеазы. Разрушая IgA-антитела, они лишают их главной функции — способности подавлять адгезию инфекционных агентов на эпителиальных клетках.
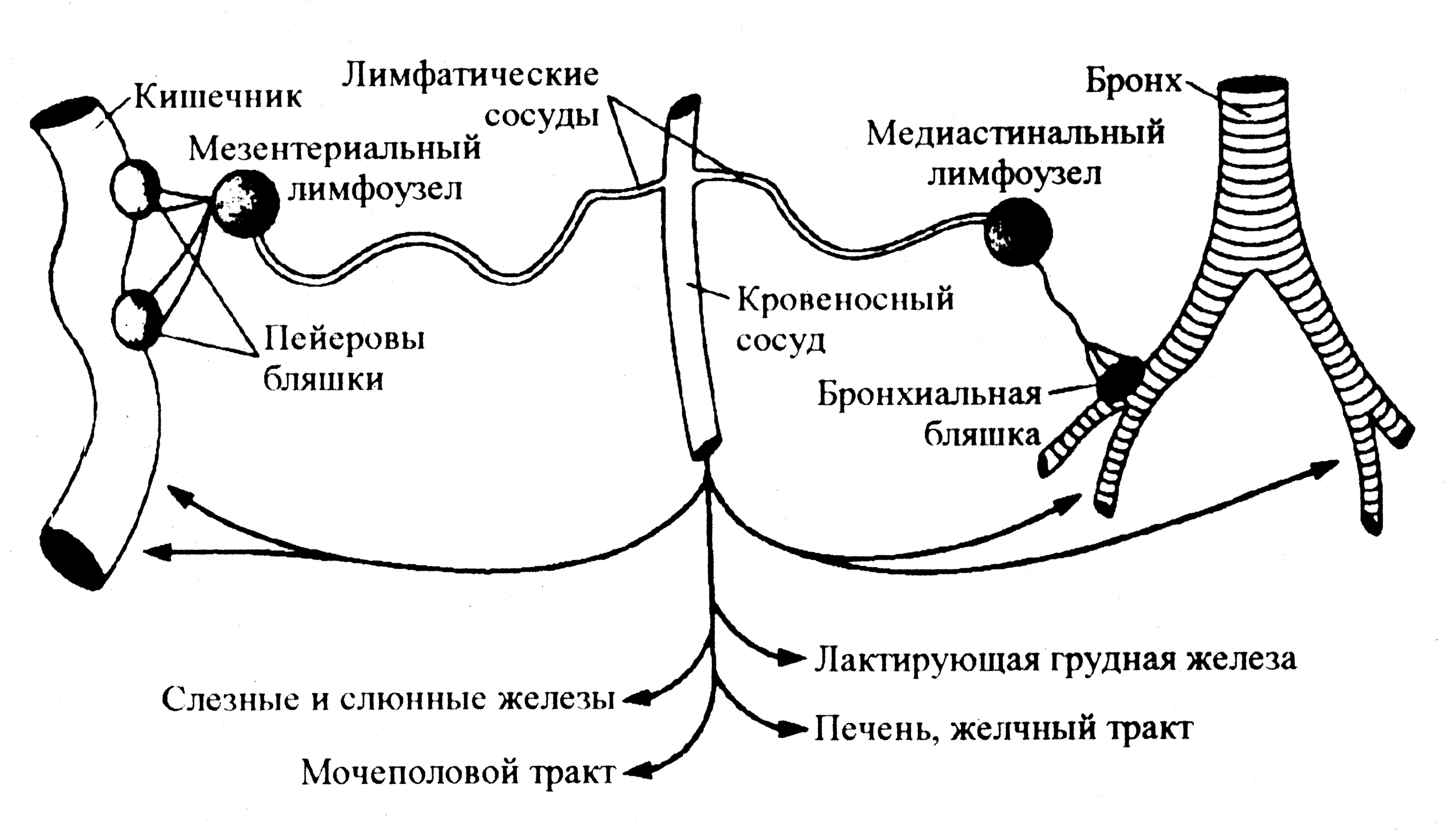
Лимфоидная ткань, ассоциированная со слизистыми оболочками, работает в собственном режиме и в известном смысле автономна от системного иммунитета. Ее лимфоциты, стимулированные антигенами и настроенные (по выражению иммунологов, коммитированные) на синтез IgA-антител, даже после выхода в циркуляцию обычно возвращаются «домой», в субэпителиальную ткань слизистых оболочек, предпочитая решать местные задачи. Это так называемый хоминг-эффект (англ. homing — стремление к дому, очагу), который объясняется сродством лимфоцитов к рецепторам (адрессинам) эндотелия посткапиллярных венул, дренирующих мукозальный тракт (рис. 2). На избирательности хоминг-эффекта основана энтеральная вакцинация, нацеленная на создание иммунитета в масштабе общей системы слизистых оболочек путем перорального введения микробных антигенов.
Следует отметить еще один важный момент. Гомеостаз мукозального тракта во многом зависит от непрерывной регенерации эпителиоцитов, которая обеспечивается пролиферацией и дифференцировкой стволовых клеток, встроенных в слизистую оболочку. В кишечнике эту функцию выполняют клетки крипт, откуда дифференцированные энтероциты мигрируют в ворсинки и, отработав, сбрасываются в полость кишечника.
В криптах непосредственно под стволовыми клетками располагается особый тип клеток (клетки Панета), которые секретируют антибактериальные факторы — лизоцим и катионные пептиды (криптидины), похожие на дифенсины фагоцитов. Они защищают стволовые клетки от микробной контаминации, поддерживая обновление энтероцитов и сохранение целостности эпителиального покрова. О тяжелых последствиях нарушения регенерации слизистой оболочки свидетельствует картина поражения кишечника при лучевой болезни и цитостатической терапии. Из-за гибели быстро делящихся стволовых клеток и вторичного повреждения эпителиального барьера (клинически это проявляется кровоизлияниями в полость кишечника) заметно возрастает опасность септических инфекций, исходящих из кишечного тракта.
Иммунитет и воспаление
Поверхность кожи и слизистых оболочек — первый рубеж, где оказывается сопротивление инфекционным агентам. Защита здесь носит бесконфликтный характер и в основном определяется факторами, которые имеются до заражения и не требуют дополнительных реакций для своего образования или активации (исключение — антигениндуцированный синтез секреторных антител и продукция эпителиальными клетками цитокинов и катионных пептидов).
Картина меняется после проникновения (инвазии) микробов в субэпителиальную ткань. Это всегда вызывает реакцию, так как инвазии сопутствует повреждение. Стандартным ответом является воспаление, которое либо обрывает конфликт без серьезных последствий, либо разрастается до крупных осложнений. Диалектика воспаления сурова — пожертвовать частью ради целого, т.е. организма. Не дифференцируя ткани по жизненной важности, воспалительный процесс развивается везде, где нарушен гомеостаз и налицо виновник повреждения. Так, в частности, возникают абсцессы легкого, печени, мозга и т.д. Воспаление травмирует ткани, сокращает полезный объем органа и служит источником токсических начал, отравляющих организм.
Мысль об иммунитетной функции воспаления утвердилась как одно из следствий фагоцитарной теории И.И. Мечникова. Логика проста: если фагоциты защищают от микробной инвазии, то и реакция, которая обеспечивает их мобилизацию в зону поражения, выполняет ту же функцию. Безусловно, учение о воспалении шире, чем учение об антимикробной защите, но именно здесь гомеостатический смысл этого механизма проявляется особенно ярко.
Реакцию начинают «клетки тревоги» (тучные клетки и макрофаги рыхлой соединительной ткани), которые первыми реагируют на повреждение, извещая об опасности и необходимости продолжения реакции. Они секретируют множество медиаторов, которые вместе с производными плазмы повышают проницаемость сосудов, вызывая эмиграцию лейкоцитов из сосудистого русла. Это означает, что воспалительная реакция развивается благодаря последовательному подключению гуморальных факторов и клеток — резидентных (постоянно присутствующих в соединительной ткани) и мобилизуемых из крови. Данный принцип базируется на сложном (сетевом) переплетении эффекторных и регуляторных молекул, которые обслуживают воспалительный процесс, обрывая или способствуя его развитию.
Известны различные варианты воспаления. Вместе с тем, опираясь на природу его главных эффекторов (фагоцитов), можно говорить о двух основных разновидностях — нейтрофил- и макрофагзависимом воспалении. Первое носит гнойный характер и вызывается гноеродными (пиогенными) бактериями. Нейтрофилы (их изобилие придает воспалительному экссудату гнойный характер) охотно принимают помощь гуморальных факторов — комплемента и антител, которые в очаге воспаления действуют как опсонины, усиливая фагоцитарные реакции. Нейтрофилзависимое воспаление отличается острым экссудативно-деструктивным течением, но иногда обретает вялотекущий, хронический характер, являясь основой хронической пиогенной патологии. Макрофаги служат эффекторами гранулематозного воспаления, которое исходно протекает хронически с преобладанием пролиферативно-склерозирующего компонента и усиливается Тh1-цитокинами. Такие реакции наблюдаются при заражении туберкулезной палочкой, листериями, возбудителями проказы, бруцеллеза, токсоплазмоза, лейшманиоза и др. Их объединяет способность к длительному выживанию (персистенции) внутри макрофагов (см. ниже).
Защита от внутрисосудистой инвазии
Чтобы попасть в кровь, инфекционный агент должен преодолеть барьер из лимфатических узлов, располагающихся по ходу лимфатических сосудов. Здесь много макрофагов, которые, занимая стратегически выгодную позицию в сосудистых синусах, извлекают из лимфы чужеродных агентов. Впрочем, и сама тканевая жидкость не безобидна для микробов: в лимфе содержатся комплемент, антитела и другие элементы плазменного транссудата, которые обладают прямой антимикробной активностью или усиливают реакции макрофагов, выступая в роли опсонинов.
Резидентные факторы лимфы и лимфатических узлов не всегда способны уничтожить возбудителя. В таких случаях здесь, как и в субэпителиальной ткани, возникает воспаление (лимфаденит), причем основной удар принимают близлежащие (регионарные) узлы. Воспалительный процесс (об этом говорит увеличение и болезненность лимфоузлов) задерживает распространение инфекции не только за счет уничтожения микробов, но и благодаря снижению скорости лимфотока, который при сильном разбухании и повреждении лимфоузла может вообще прекратиться. Но и это не всегда останавливает инфекцию. Возбудитель проникает в эфферентную лимфу и далее в кровоток. Иногда инвазия в лимфу и кровь происходит бессимптомно. К примеру, некоторые вирусы и другие внутриклеточные паразиты проникают в кровяное русло, инфицируя (но не повреждая) моноциты или лимфоциты, которые разносят их по организму еще в инкубационном, т.е. доклиническом периоде.
Уцелеть в кровеносном русле рядовым микробам тоже непросто. Прежде всего сама кровь — не очень подходящая среда для размножения бактерий. Лишь после прогревания или разведения она становится пригодной для этих целей. Кровь — продукт многих тканей, и поэтому в ней содержится множество биологически активных начал, включая антимикробные (биоцидные, биостатические, опсонические) факторы. В виде резидентных (лимфа) или мобилизуемых при воспалении факторов их действие продолжается в тканях, где оседают микробы.