Содержание
Причины активации латентных вирусов (так же, как корни самой персистенции) следует анализировать по двум направлениям — на уровне клеток и на уровне организма. И в том и другом случае могут быть виновны вирус или хозяин, но в основе всегда лежит ослабление контроля над вирусом. Это переводит латенцию на рельсы продуктивной инфекции или хотя бы дерепрессирует вирусные гены, продукты которых приносят прямой или опосредованный вред хозяину. Вирусы меняются в результате мутаций, генетических рекомбинаций, генотипического или фенотипического смешивания с вирусами-помощниками. Отсюда толчком к активации может быть воздействие физических и химических факторов, оксидантного стресса, суперинфекции. Например, температурозависимые мутанты оживают при повышении температуры, а риновирусы активируются при охлаждении. Для репликации вируса гепатита D требуется присутствие вируса гепатита В, некоторые из парвовирусов нуждаются в помощи аденовирусов или вирусов простого герпеса. Иногда латенцию удается нарушить при сокультивировании с чувствительными (пермиссивными) клетками.
Одним из общих условий для патогенетически значимой активации вирусов является ослабление резистентности хозяина. С наибольшей очевидностью это проявляется у больных с ятрогенной и ВИЧ-иммунодепрессией. Одной из серьезных проблем в таких случаях являются эндогенные рецидивы герпетических инфекций на фоне подавления Т-клеточного иммунитета. Впрочем, и нормально работающая иммунная система не только не гарантирует защиты от клинически значимой персистенции вирусов, но и участвует в реализации ее патогенетического потенциала. Это совершенно необходимо для вирусов, которые лишены собственной цитотоксичности, формально безвредны для изолированных клеток, но обретают болезнетворность, подключая эффекторы иммунитета.
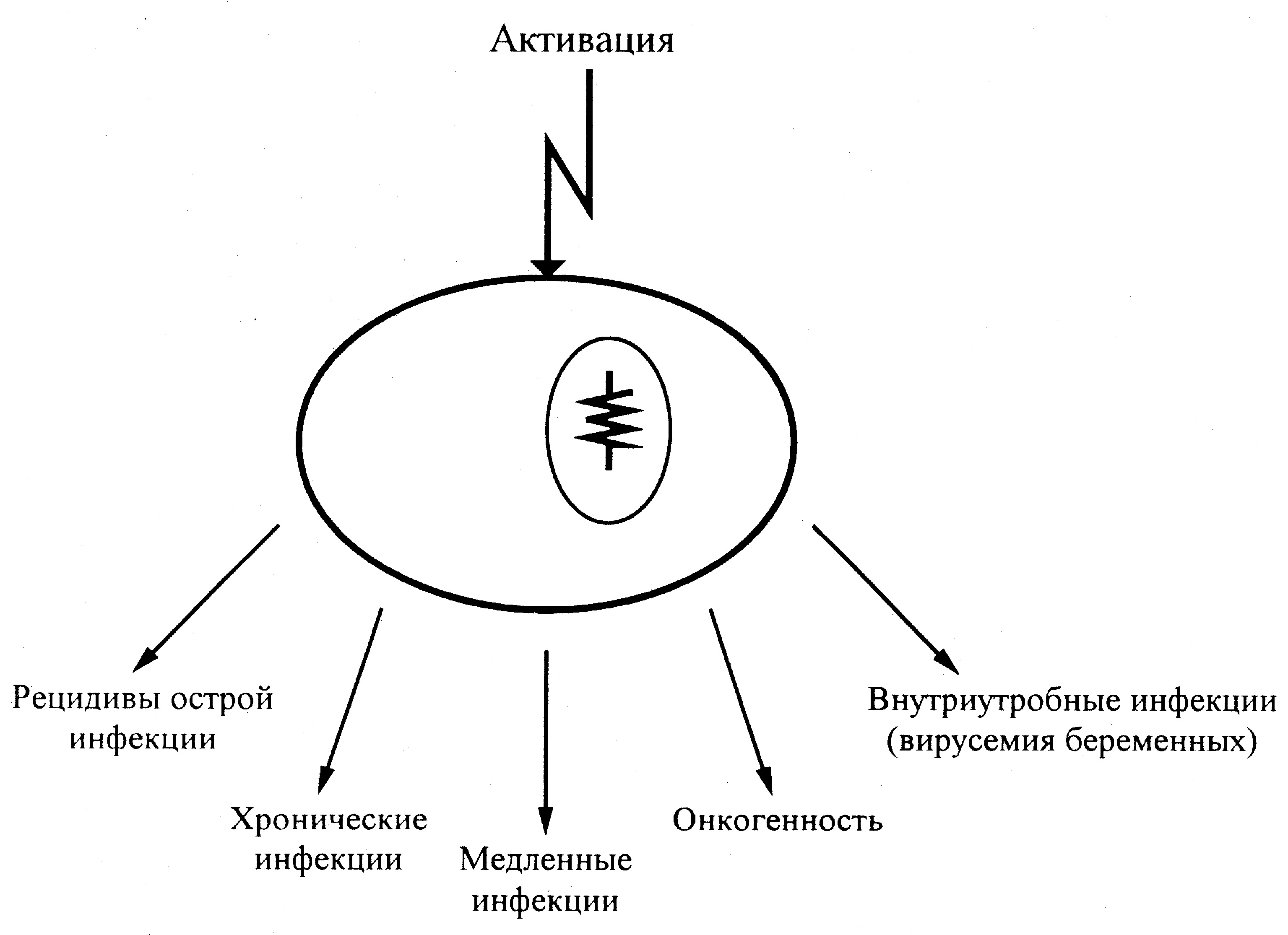
Активация персистентных вирусов ведет к разнообразным клиническим последствиям, которые, как и при обычных инфекциях, отражают избирательную цитотропность и особенности взаимоотношений в системе «вирус-клетка». Памятуя об этом, их можно объединить в несколько групп (рис. 5). Рецидивы острых поражений типичны для вирусов с прямой цитотоксичностью (вирусы простого герпеса, ветряной оспы, опоясывающего лишая, цитомегаловирус). Хроническое течение имеет обычно иммунопатогенетическую основу (например, гепатит В). Опасность внутриутробного инфицирования возникает при вирусемии беременных, предрасполагающей к трансплацентарной (вертикальной) передаче возбудителя (цитомегаловирус, вирус гепатита В, ВИЧ). Онкогенность обычно связана с интегративными инфекциями, когда вирусы, дестабилизируя клеточный геном, способствуют экспрессии его онкогенов (точнее — протоонкогенов).
Особой категорией являются медленные нейроинфекции — подострые спонгиозные (губчатые) вирусные энцефалопатии. Они характеризуются длительным (несколько лет) инкубационным периодом и, прогрессируя без ремиссий, неизбежно ведут к смерти на фоне необратимой дегенерации нейронов. Возбудители некоторых из них совершенно уникальны: это инфекционные белки, лишенные генетического материала (ДНК или РНК). Именно поэтому они получили название прионов (сокращение двух слов — протеин и инфекционный). О прионах говорят как о неканонических вирусах, так как отсутствие нуклеиновой кислоты возводит их в ранг самостоятельной формы живой материи, заставляя вспомнить Ф. Энгельса: жизнь — есть способ существования белковых тел. Прионы устойчивы к обычным физическим и химическим воздействиям, включая ультрафиолетовое и ионизирующее облучение, ультразвук, нагревание, антисептики. Не имея нуклеиновой кислоты, они в отличие от обычных вирусов не инактивируются нуклеазами и не чувствительны к интерферону. Прионные поражения не сопровождаются воспалительной реакцией и не вызывают иммунного ответа. Поэтому они не несут специфических иммуносерологических маркеров и диагностируются лишь на основании клинических и аутопсийных признаков.
Сюрпризом явилось обнаружение прионов не только в пораженной нервной ткани (он накапливается здесь в виде амилоидных бляшек), но и в нормальных клетках, причем не только в нейронах. По-видимому, он выполняет здесь какие-то физиологические функции, о которых можно только гадать. Не исключено, например, что нормальный прион (в отличие от патогенного PrPSc-белка, он обозначается PrPC) необходим для стабилизации нейронного сообщества ЦНС, прежде всего головного мозга.
Происхождение прионовой патологии видится сегодня следующим образом. Действуя аутокаталитически, экзогенные прионы вызывают конформационные изменения в клеточном прионе, переводя его в патогенетически значимые изоформы. Обладая устойчивостью к внутриклеточным протеазам, PrPSc накапливаются в клетках, вызывая дегенеративные изменения. Полагают, что реакция носит цепной характер: молекула PrPSc cоединяется с PrPC с образованием гетеродимерного продукта, который трансформируется в две молекулы PrPSc; в следующем цикле две молекулы PrPSc связываются с PrPC, давая начало четырем PrPSc; в третьем цикле каждая из них соединяется с PrPC, генерируя восемь молекул PrPSc и т.д. Это обеспечивает экспоненциальный рост PrPSc.
Прионы являются причиной нескольких заболеваний человека (куру, болезнь Крейтцфельдта—Якоба, синдром Герстманна—Штреусслера—Шейкера, фатальная семейная инсомния), а также нескольких болезней животных (скрэпи овец и коз — отсюда акроним «Sc” в PrPSc, инфекционная энцефалопатия домашних норок, хроническое истощение одомашненных оленей и лосей, трансмиссивная губчатая энцефалопатия коров — болезнь «бешеных коров» и др.). Прионы способны преодолевать видовые барьеры, что отражает эволюционный консерватизм приона, сохранившего структурное сходство у большинства млекопитающих. Это, в частности, спровоцировало нашумевшую историю в связи с постулированной, но недоказанной возможностью заражения человека прионами болезни Крейтцфельдта—Якоба через мясо «бешеных» коров.
Избирательное поражение ЦНС заслуживает отдельного комментария. Оно не связано со специфической рецепцией прионов нейронами, так как при периферийном введении прежде чем попасть в мозг, прионы обнаруживаются в ретикулоэндотелиальной системе. Но так же как в перевиваемых клеточных линиях они никогда не накапливаются здесь в высоких титрах. Это объясняется тем, что клетки делятся чаще, чем удваивается количество прионов, а потому самостерилизуются. Размножение прионов идет очень медленно со временем удвоения примерно 5 дней, и для накопления патогенетически значимой концентрации требуются многие недели, а нередко — месяцы. Поэтому не удивительно, что прионы поражают только нейроны, которые лишены способности к делению.
Этиология медленных нейроинфекций не ограничивается прионами. Их причиной могут быть и обычные, канонические вирусы, персистирующие в ЦНС. Кстати, именно с них началось изучение этой удивительной патологии. Начало положил Б. Сигурдсон, доказавший инфекционную природу болезни висны-мэди овец, завезенных в Исландию из Германии для развития каракулеводства. Эти исследования начались в конце 1930-х гг., но лишь в 1954 г. Б.Сигурдсон сформулировал основные положения концепции о медленных инфекциях. Возбудителем висны-мэди (исл. «чахнущий» и «одышка») оказался ретравирус, чем поставил немало вопросов. Неожиданным, например, явилось то, что он отлично размножается в клеточных культурах, вызывая острый (т.е. быстрый) цитопатический эффект. Иными словами, отсроченное и медленное поражение ЦНС связано с особенностями поведения вируса в инфицированном организме, а не с его биологической уникальностью. Было установлено, что возбудитель бессимптомно персистирует в макрофагах, а его распространение сдерживается антителами. В вирусной популяции вызревают ускользающие мутанты, и не исключено, что именно они обеспечивают эволюцию процесса.
Человек не заражается вирусом висны-мэди, но у него есть свои медленные нейротропные вирусы. Прогрессирующая дегенерация нейронов головного мозга наблюдается при ВИЧ-инфекции, являясь одним из центральных проявлений синдрома приобретенного иммунодефицита. Вирус кори, персистируя в нейронах головного мозга, вызывает подострый склерозирующий энцефалит. Опасны паповавирусы (прогрессирующая многоочаговая лейкоэнцефалопатия), вирус краснухи (прогрессирующий панэнцефалит как последствие врожденной краснухи), цитомегаловирус (цитомегаловирусная инфекция мозга), вирус простого герпеса (подострый энцефалит), аденовирусы типов 7 и 32 (подострый энцефалит), вирус клещевого энцефалита и другие тогавирусы (эпилепсия Кожевникова и прогрессирующий бульбарный паралич). Продолжаются поиски этиологических агентов таких медленных заболеваний ЦНС, как рассеянный склероз, болезнь Паркинсона, шизофрения, болезнь Альцгеймера.