Содержание
Гораздо меньше согласия у ученых в признании патогенетического потенциала L-персистенции. Несмотря на то, что ряд авторов поддерживает участие L-форм в развитии этиологически нерасшифрованных, хронических заболеваний (аутоиммунные процессы, ревматизм и гломерулонефрит, болезнь Крона и пр.), многие считают это недоказанным.
Одним из поводов к сомнениям является хрупкость L-форм. Для их выживания требуются гипертонические питательные среды, уравновешивающие внутриклеточное осмотическое давление (этого добиваются при помощи сред с высокой концентрацией поваренной соли или сахарозы). Но известны и соленезависимые варианты (те же L-формы S. moniliformis), которые «самостабилизируются» за счет системы внутренних мембран, отсутствующей у бактериальных форм. Следует помнить и о том, что между бактериями с полноценной клеточной стенкой и вариантами, лишенными пептидогликана, есть переходные (промежуточные) формы с различной выраженностью дефекта.
Есть мнение, что конверсия в L-формы достаточно распространена в природе как один из этапов циклического развития бактерий. C этой точки зрения для индукции L-форм вовсе не обязательны искусственные манипуляции, побуждающие сомневаться в реальности феномена in vivo. Уже давно, например, сообщалось о том, что тот же пенициллин не столько индуцирует, сколько селекционирует спонтанно образовавшиеся L-клетки стрептококков. Фактология о дремлющих дефектных бактериях недавно получила серьезное методическое подспорье в виде полимеразной цепной реакции, позволяющей улавливать контаминацию тканей даже в тех случаях, когда возбудитель не обнаруживается традиционными способами (см. «Диагностика инфекционных заболеваний»).
В 1985 г., критически оценивая проблему, С.В. Прозоровский резюмировал: «На смену большим ожиданиям пришел жесткий анализ фактов. L-формы могут иметь значение далеко не при всех инфекционных процессах. Наиболее вероятна их роль в развитии хронических и рецидивирующих инфекций. Система доказательств представляется достаточно сложной, она требует дальнейших исследований и новых фактов».
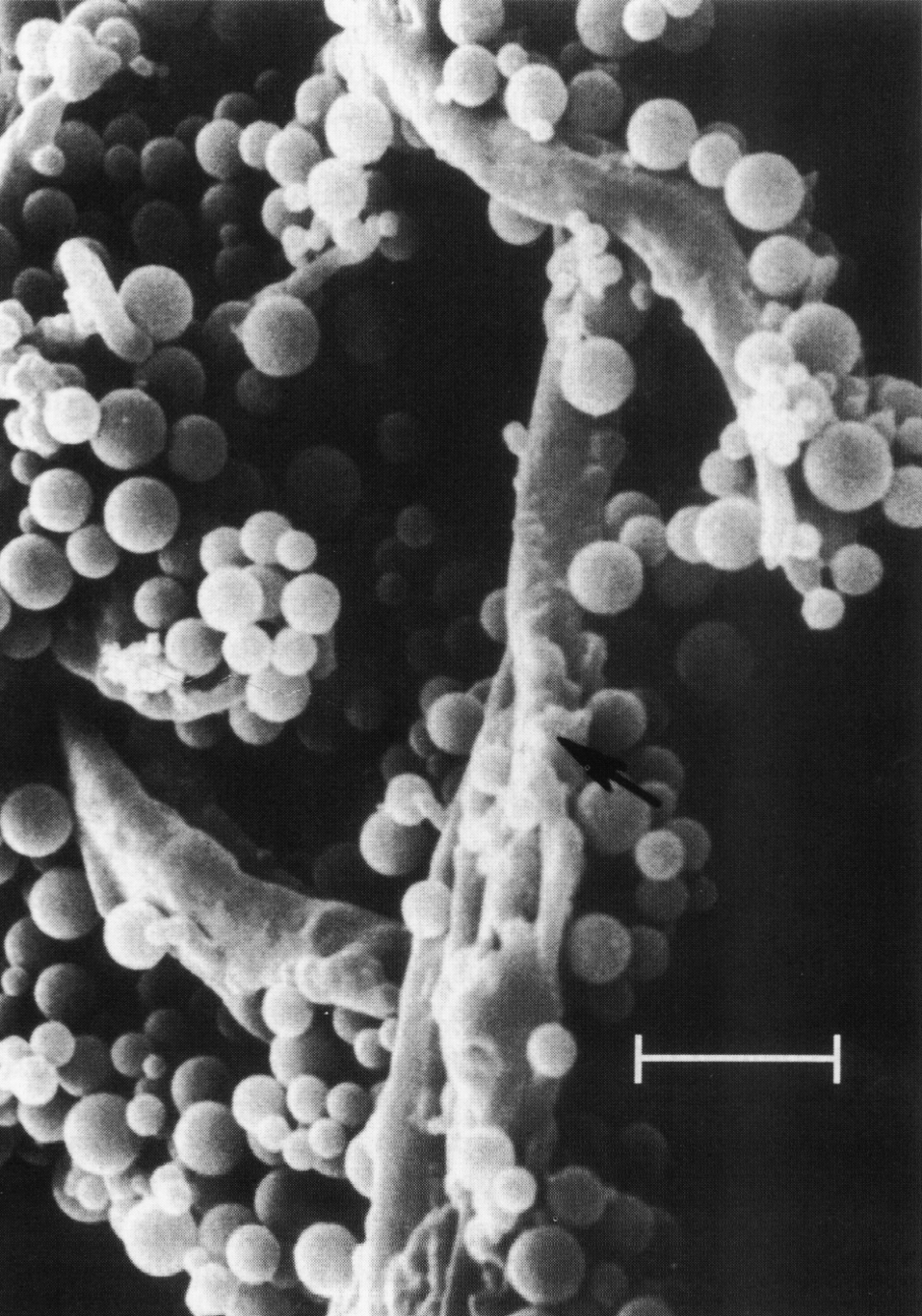
Свидетельством того, что проблема жива, продолжая интриговать патологов и микробиологов, является аналитический обзор новых идей и фактов по поводу патогенетического значения L-персистенции, опубликованный в одном из журналов Американской ассоциации микробиологов2, где, в частности, говорится о целесообразности более широкого применения антимикробных средств при идиопатических, хронических и травмирующих процессах несмотря на отсутствие классических (культуральных) доказательств их бактериальной природы. Использование новых микроскопических и генетических маркеров в ряде случаев позволяет думать о присутствии гипотетического возбудителя, оправдывая применение этиотропных препаратов (см. рисунок).
Микробные сообщества (биопленки). В широком смысле к ним относятся любые агрегаты бактерий на интерфазных (вода-субстрат) поверхностях — от диффузного монослоя до массивных слизистых структур, видимых невооруженным глазом. Зрелая биопленка (англ. biofilm) представляет собой микробные образования в органическом матриксе (гликокаликсе), который включает белковые дериваты и протеогликаны хозяина. Они готовят адгезию бактерий. Биопленки являются одной из причин бактериальной персистенции, содействуя общению между микробами одного или разных видов. Они могут быть разделены каналами для поступления питательных веществ и выведения отходов. Бактерии имеют здесь разную активность, выполняя функции жизнеобеспечения всего сообщества. Не случайно биопленки называют «городами микробов», сравнивая с тканями многоклеточных организмов.
Формирование биопленки — многоступенчатый процесс. Он включает адгезию планктонных (взвешенных) клеток, закрепление адгезивных контактов и развитие многослойной структуры внутри гликокаликса. Это ведет к изменению бактериального фенотипа с индукцией множества генов, не работающих в планктонном состоянии. Бактериальные клетки периодически покидают биопленку, создавая возможность обострений и новых очагов инфекции. Переход в планктонное состояние контролируется феромонами — молекулами межклеточного общения. Используя их аналоги, удается предотвратить формирование биопленки, сдвигая баланс в сторону планктонного статуса. Это повышает чувствительность бактерий к антибиотикам и эффекторам иммунитета, помогая лечению и профилактике персистентных инфекций.
В составе биопленок бактерии имеют ряд преимуществ, к которым относятся способность к выживанию и экспрессия генов вирулентности. Во-первых, окруженные гликокаликсом бактерии недоступны для эффекторов иммунитета. Поэтому биопленочное воспаление характеризуется низкой результативностью, обретая хронический характер. Реакции хозяина в лучшем случае неэффективны, а в худшем — сопряжены с повреждением собственных тканей. Не случайно для подавления биопленочных сообществ некоторые клиницисты рекомендуют назначение иммунодепрессантов. Во-вторых, биопленки обладают высокой резистентностью к антибиотикам: она в среднем в 1000 раз выше, чем у планктонных вариантов. Кроме низкой проницаемости, это обусловлено также метаболическими особенностями биопленочных бактерий. Часть из них пребывают здесь в малоактивном (даже инертном) состоянии, а потому индифферентны к антибиотикам. Внутри биопленок поддерживаются условия для генетического обмена, в том числе для приобретения генов резистентности к антибиотикам.
Биопленочная патология. Биопленочные инфекции можно разделить на две группы — процессы, происходящие в собственных тканях хозяина, и инфицирование инородных предметов, вводимых в качестве протезов, катетеров и пр. Классическим примером патологий первого типа является зубная бляшка. В зрелой бляшке насчитывается несколько сот видов бактерий. Многие из них не удается культивировать, и об их присутствии судят по генетическим маркерам. Зубные бляшки служат причиной кариеса и пародонтита. При кариесе зубная эмаль разрушается органическими кислотами, которые образуются при сбраживании углеводов бактериями, прежде всего оральными стрептококками. Пародонтит формируется при распространении бляшки в субгингивальное пространство, где имеются условия для интенсивного размножения анаэробных бактерий с выраженным деструктивным и провоспалительным потенциалом (порфиромонады, превотеллы, фузобактерии). Хронизация процесса ведет к разрушению периодонтальных тканей и выпадению зубов.
Зубная бляшка — отличная модель, демонстрирующая фазы и механизмы развития бактериальной биопленки. События начинаются с подготовки зубной поверхности саливарными белками. Это обеспечивает адгезию и размножение первой партии бактерий — стрептококков и актиномицетов. Они продуцируют внеклеточные полисахариды (декстраны, леваны), образуя раннюю биопленку. К ранней биопленке прикрепляются другие виды бактерий, из которых формируется зрелая зубная бляшка — многослойная (толщиной до 100 мкм) полимикробная структура, скрепленная микробными и саливарными полимерами. Стабильность зубных бляшек (для их удаления необходима интенсивная чистка зубов) отличает их от экологии слизистых оболочек, которые обновляются каждые несколько дней. При слущивании мукозального эпителия удаляются микроорганизмы, оставляющие потомство на новых клетках. Поэтому микробные сообщества нормальных слизистых оболочек являются монослойными, не достигая организации зрелых биопленок. Тем не менее известны заболевания, связанные с образованием микробных сообществ на мукозальных поверхностях. Полагают, что около 60% бактерийных инфекций так или иначе связаны с биопленками или сходными с ними образованиями. К наиболее типичным патологиям относятся септический эндокардит и муковисцидоз, хотя в любой хронической инфекции можно подозревать участие биопленочного процесса.
Септический эндокардит объединяет хронические бактериальные инфекции клапанов сердца. В типичных случаях бактерии колонизируют тромбоподобные массы, которые откладываются при бактериемии на поврежденном эндотелии (ревматический порок, хирургические вмешательства). Источником бактериемии обычно служит ротовая полость, реже — интестинальный и урогенитальный тракты. Этим определяется микробный профиль эндокардитов, в котором преобладают оральные стрептококки; далее следуют стафилококки и грамотрицательные бактерии. Нередко инфекция носит смешанный характер.
Бактерии прикрепляются к элементам тромба, образуя микроколонии, которые покрываются новыми тромбоотложениями. Повторение циклов ведет к развитию многослойных биопленочных структур — так называемых вегетаций. Они служат источником септической интоксикации, а также причиной органических повреждений клапанов сердца и миокарда, тромбоэмболий. При дентальных или других инвазивных операциях больным с повышенным риском эндокардита рекомендовано назначение антибиотиков. Это делается для того, чтобы убить планктонные бактерии в сосудистом русле, прежде чем они сформируют биопленочное сообщество на клапанах сердца.