Содержание
Разговор об устойчивости к вирусам мы начали с антигензависимого (специфического) иммунитета, для развития которого требуется довольно много времени. Между тем так же, как при любой инфекции, вирусы получают отпор с момента инфицирования. Это достигается благодаря факторам, которые предсуществуют до заражения или активируются тотчас после него. Среди последних лучше всего изучены интерфероны — разновидность цитокинов с антивирусной активностью. Существует три типа интерферонов (a, b и g), которые различаются по происхождению, физико-химическим свойствам и биологической активности. Интерфероны a и b (интерфероны типа I) секретируются всеми клетками, хотя и сохраняют свои исторические названия — лейкоцитарный (a) и фибробластный (b). Интерферон g (интерферон типа II) продуцируется главным образом активированными Т-лимфоцитами и естественными киллерами и поэтому называется иммунным. Известно более 20 разновидностей g -интерферонов и по одной a- и b-интерферонов.
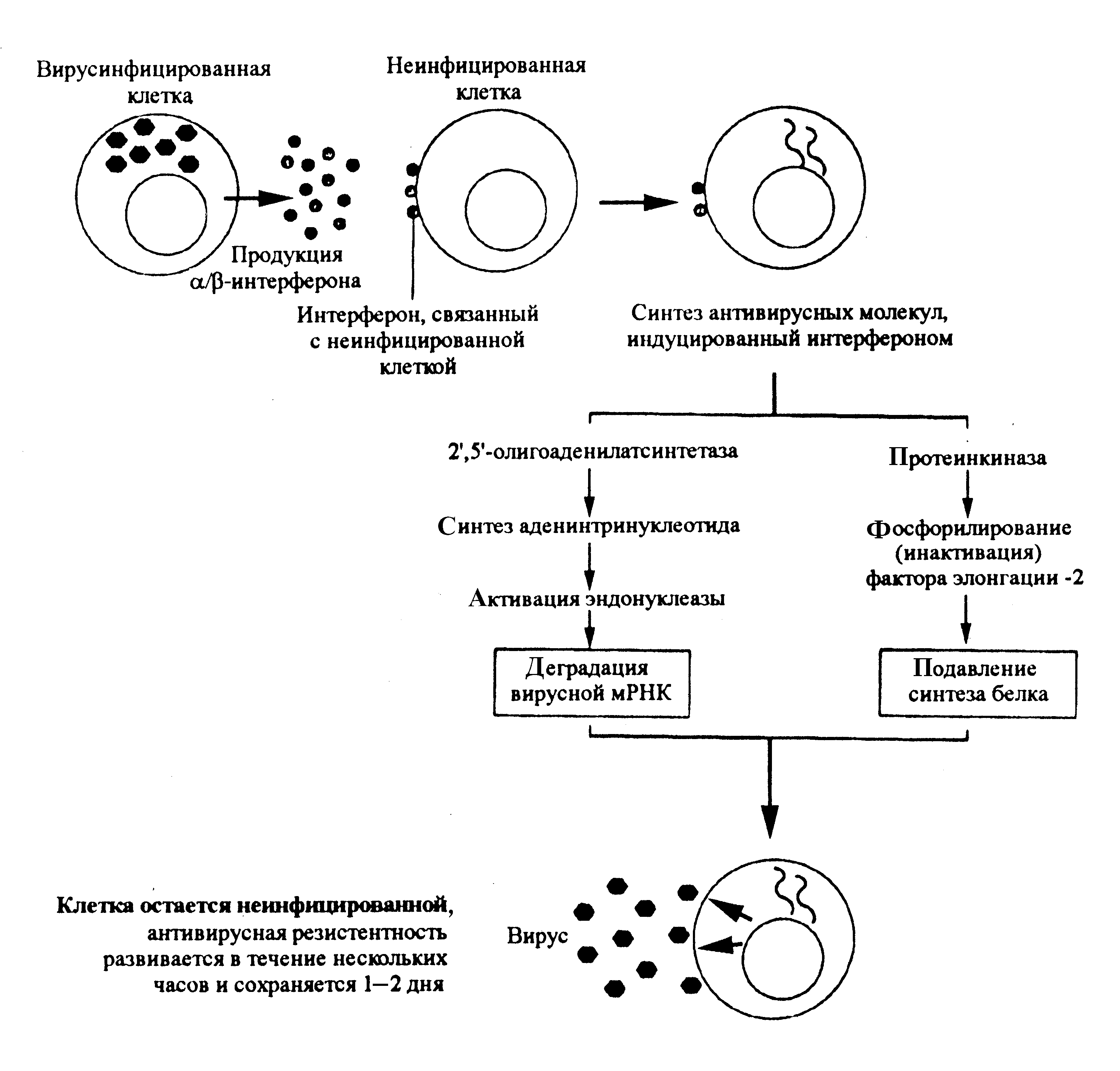
Впервые о вирусной интерференции заговорили в 1957 г., когда было обнаружено, что вирусинфицированные клетки секретируют фактор, подавляющий репликацию вируса в соседних клетках. Механизм этого явления сводится к следующему. При заражении вирусом клетка начинает секретировать интерфероны, которые связываются со специфическими рецепторами соседних клеток. a- и b-интерфероны реагируют с общим рецептором, для g-интерферона имеется отдельный рецептор. Связывание интерферонов побуждает клетку к синтезу по крайней мере двух ферментов, которые блокируют синтез вирусных белков, разрушая вирусные мРНК и подавляя их трансляцию на рибосомах (рис. 3). Благодаря торможению вирусной репликации создается барьер из клеток, устойчивых к вирусу и сдерживающих его распространение. То, что это действительно важно, доказывают опыты на животных: блокада интерферонов антителами в сотни раз повышает чувствительность мышей к вирусной инфекции. Кстати, для интерферонов характерна видовая специфичность: каждый вид животных имеет собственные интерфероны и не чувствителен к чужим аналогам.
Интерфероны a и b образуются быстро (в течение 24 ч) и поэтому служат важным фактором экспресс-защиты; g-интерферон секретируется гораздо позднее (после дифференцировки Т-эффекторов) и сам по себе слабо влияет на репликацию вирусов. Антивирусный эффект g-интерферона скорее определяется тем, что он повышает МНС-II-зависимую экспрессию вирусных антигенов на поверхности зараженных клеток, делая их более заметной мишенью для Т-хелперов, а также усиливает цитотоксические функции макрофагов и естественных киллеров. Действие a- и b-интерферонов тоже не ограничено подавлением внутриклеточного вируса. Они стимулируют экспрессию молекул МНС-I, повышая эффективность цитотоксических реакций CD8 Т-лимфоцитов.
Кроме вирусов, интерфероны усиливают резистентность к риккетсиям, микобактериям, простейшим. Это неудивительно, так как, подобно вирусам, эти микробы размножаются внутри клеток, делая их мишенью для Т-лимфоцитов и антирепликативного эффекта интерферонов. Способностью индуцировать синтез интерферонов (речь идет об a- и b-интерферонах) обладают многие микробные продукты (например, липополисахаридные эндотоксины) и синтетические вещества (полианионы, двухспиральные РНК). Они называются интерфероногенами и так же, как сами интерфероны, используются в клинике.
После того, как интерфероны научились получать генно-инженерным способом, рынок постоянно пополняется рекомбинантными интерферонами, которые испытываются при различных вирусных и невирусных инфекциях. Контролируемые опыты говорят об эффективности a-интерферона при хронических гепатитах В и С, герпетических и ряде других инфекций. Интерфероны применяются и в лечении опухолей, особенно при злокачественных заболеваниях крови. Расчет строится на их универсальной антипролиферативной активности, которая проявляется в торможении синтеза вирусных, но и (хотя более слабо) клеточных белков. Имеет значение и то, что интерфероны усиливают эффекторные функции макрофагов и естественных киллеров, а также МНС-зависимую презентацию антигенов Т-лимфоцитам.
К сожалению, клинические результаты, как правило, хуже того, что можно было ожидать, исходя из высокой протективной активности естественно образующихся интерферонов. Кроме того, подобно другим цитокинам, интерфероны имеют множество мишеней в организме и при длительном применении дают осложнения, препятствующие продолжению терапии (лихорадка, слабость, мышечные боли, токсичность для почек, печени, костного мозга, миокарда и пр.).
Кроме интерферонов в доиммунном (т.е. до приобретения специфического иммунитета) надзоре за вирусинфицированными клетками принимают участие естественные киллеры (NK-клетки). Это неоднородная популяция клеток, которые морфологически похожи на лимфоциты или несколько крупнее (большие гранулярные лимфоциты). NK лишены рецепторов, распознающих антигены, и потому не способны к специфическим (антигензависимым) реакциям. В них есть гранулы, которые содержат цитотоксические факторы, аналогичные перфорину, гранзимам и гранулолизину Т-киллеров. В периферическом пуле лимфоцитов NK представлены неравномерно. В крови они составляют 10—15% мононуклеаров, доминируя среди так называемых О-клеток (лимфоциты, лишенные маркеров В- и Т-лимфоцитов). Их много в печени, селезенке и костном мозге, мало в лимфатических узлах, слизистых оболочках и практически нет в тимусе.
Особенностью NK-клеток является двойственность механизма распознавания клеток-мишеней. Они располагают двумя типами рецепторов: одни активируют, а другие блокируют NK-цитотоксичность. Активирующие рецепторы распознают структурную чужеродность клеток, блокирующие — взаимодействуют с молекулами МНС-I. Связывание с МНС-I инициирует сигнал, подавляющий NK-агрессивность. Это защищает нормальные ткани от NK-повреждения, предрасполагая к уничтожению клеток, дефектных по МНС-I. Такие клетки возникают при вирусных инфекциях и опухолевых процессах. Они неуязвимы для Т-киллеров, и именно здесь NK-реакции представляются наиболее значимыми.
NK убивают вирусинфицированные и опухолевые клетки. Подобно макрофагам, они могут делать это без посторонней помощи, но такие реакции лишь частично раскрывают их эффекторные ресурсы. Активация Th1-цитокинами (прежде всего ИЛ-2) значительно усиливает агрессивность NK-клеток и расширяет спектр атакуемых объектов.
Кроме цитотоксичности NK-клетки наделены медиаторными функциями. При активации они секретируют цитокины (g-интерферон, ФНО-a, ИЛ-8, ГМ-КСФ и др.), которые в зависимости от обстоятельств оказывают стимулирующее или супрессорное воздействие на лимфоциты, моноциты/макрофаги, кроветворные клетки и пр. В этом отношении они близки другим клеткам иммунной системы, таким как Т-лимфоциты, макрофаги и тучные клетки.
Проблема противовирусного иммунитета получила отражение и в концепции апоптоза в связи с представлениями о так называемом альтруистическом самоубийстве клеток. Подразумевается, что, реагируя на вирусную инвазию, клетки предпочитают погибнуть, чтобы опередить репликацию вируса, опасного для своих соседей и организма в целом. Некоторые вирусы препятствуют этому: блокируя апоптоз, они создают условия для продуктивной инфекции. Это достигается разными способами, но принцип сводится к двум механизмам — повышение экспрессии антиапоптозных (ростстимулирующих) генов клетки и инактивация эффекторных молекул апоптоза. Такую функцию несут гены, экспрессируемые в начале репликативного цикла. Поздние вирусные гены могут кодировать факторы, которые усиливают апоптозный процесс, содействуя цитопатогенному эффекту.
***
Вряд ли будет ошибкой, если тактическое и стратегическое разнообразие антимикробной защиты поставить в эволюционную зависимость от патогенетической изощренности инфекционных агентов. Всякое действие рождает противодействие, и именно многоликость микробных инвазий и интоксикаций определила потребность в усложнении механизмов иммунитета. Несмотря на впечатляющий арсенал конститутивных и индуцибельных механизмов, аппарат противоинфекционной защиты лишен совершенства. Впрочем, он и не может быть безупречен, так как ему противостоит эволюция инфекционных агентов, стремящихся к общей для всего живого цели — выжить и закрепиться в биосфере. По адаптации к новым условиям микробы значительно превосходят высшие организмы. В известной мере это компенсируется системой иммунного реагирования, функционирующей благодаря совместным усилиям факторов врожденного и адаптивного иммунитета.