Содержание
Разновидностью дефектных вирусов являются так называемые температурозависимые мутанты, которые не реплицируются при 37оС (т.е. нормальной температуре тела), но размножаются при повышенных температурах. Альтернативой являются риновирусы — главные возбудители малых простудных заболеваний (острого катара верхних дыхательных путей). Они тоже температурозависимы, но предпочитают пониженную температуру. Персистируя в назальном эпителии, где и без того «холодно», риновирусы активируются при дополнительном охлаждении (простуда!).
Проблема вирусной персистенции получила отражение и в концепции апоптоза. Подразумевается, что при так называемом альтруистическом самоубийстве, реагируя на вирусную инвазию, клетки предпочитают погибнуть, чтобы опередить репликацию вируса, опасного для своих соседей и организма в целом. Некоторые вирусы блокируют клеточный апоптоз, создавая условия для продуктивной инфекции или персистенции. Они добиваются этого, повышая экспрессию ростстимулирующих генов (протоонкогенов) либо инактивируя эффекторы апоптоза.
Персистенция на уровне организма
Чтобы закрепиться в организме, вирусу недостаточно «договориться» с клеткой. Как чужеродный (антигенный) объект он подвергается иммунной атаке, нацеленной на уничтожение вируса и зараженных им клеток. Это означает, что на уровне организма персистенция предполагает еще одно условие: вирус должен избежать элиминирующих реакций в системе иммунологического надзора. Главное здесь — выживание не свободного вируса, а зараженных клеток, т.е. персистенция не самого вируса, а содержащих его клеток.
Персистенция затрагивает практически все факторы антивирусной защиты. Многие обобщения гипотетичны и служат скорее ориентиром для дальнейших исследований, которые могут утвердить их или опровергнуть. Но они представляют несомненный интерес, отражая стремление расшифровать одно из базисных понятий вирусологии. Мы сконцентрируем внимание на взаимоотношениях вирусов с Т-лимфоцитами, так как именно от них больше всего зависит судьба инфицированных клеток. Антитела предупреждают заражение клеток, но не спасают от внутриклеточного вируса. Они необходимы для успешного завершения острого конфликта, но не эффективны против утвердившейся инфекции.
О противовирусном иммунитете говорится в специальном очерке (см. «Механизмы противоинфекционного иммунитета»). Здесь мы лишь напомним о том, что необходимо знать для обсуждения антииммунитетной стратегии вирусов (рис. 4). Ключевым является представление вирусных антигенов Т-лимфоцитам в комбинации с молекулами главного комплекса гистосовместимости (у человека — HLA) на поверхности зараженных клеток или клеток, поглотивших вирусные антигены. На этом этапе происходит селекция антигенчувствительных клонов, которые, подвергаясь дифференцировке и пролиферации, превращаются в Т-эффекторы, настроенные (коммитированные) против HLA-презентируемых эпитопов.
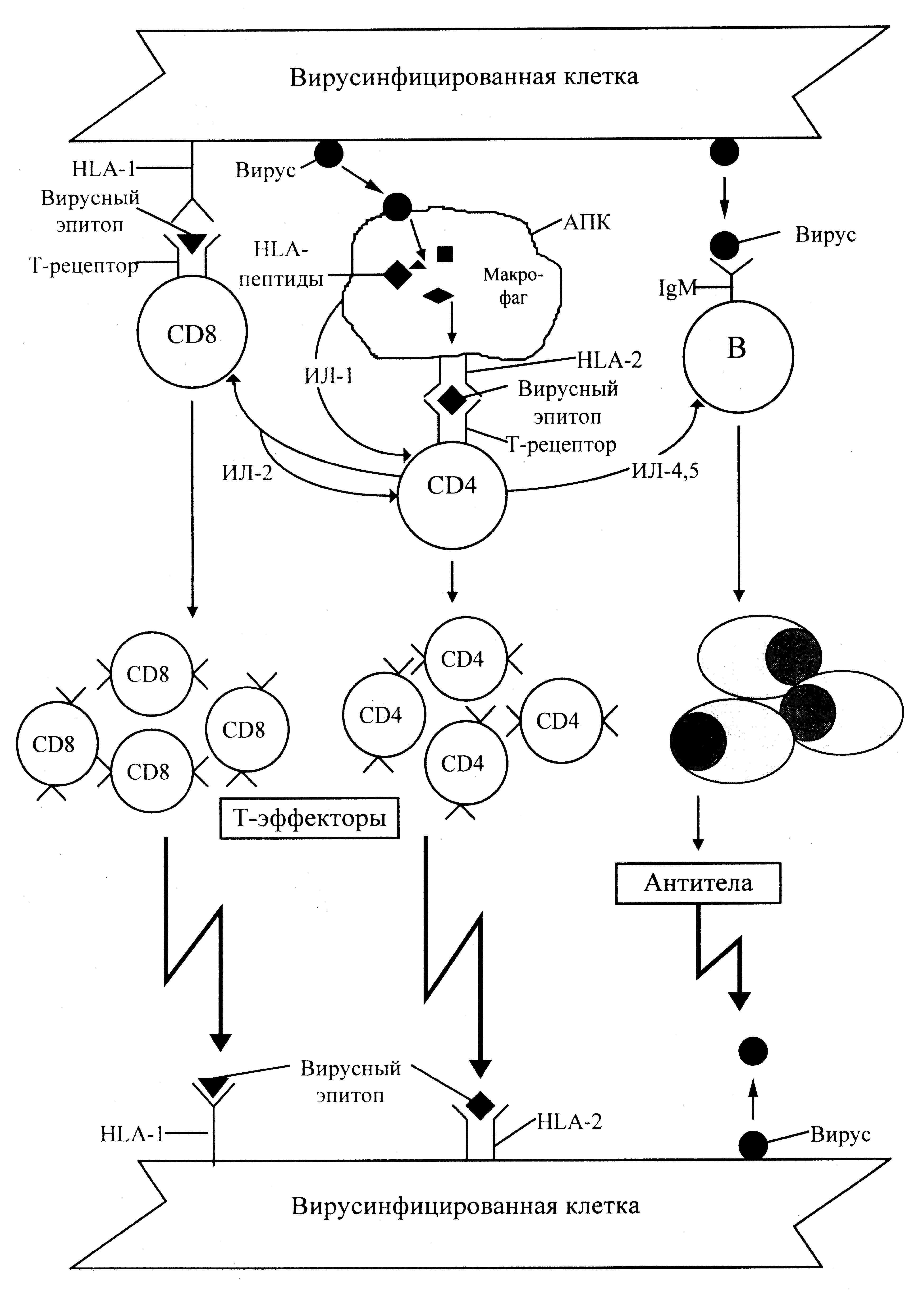
Для созревания Т-эффекторов необходимы дифференцировочные и ростстимулирующие сигналы хелперных CD4 Т-лимфоцитов. Но перед этим T-хелперы сами подвергаются активации, превращаясь в источник разнообразных цитокинов. Главная роль принадлежит Тh1. Они помогают активации цитотоксических Т-лимфоцитов и других эффекторных клеток, прежде всего макрофагов.
Реализация иммунного ответа против внутриклеточных вирусов связана с цитотоксическими Т-лимфоцитами (СТL). Неспецифические клетки-эффекторы дополняют их антивирусную активность.
Из сказанного вытекают два правила, следуя которым вирус может избежать уничтожения. Во-первых, этому способствует слабый иммунный ответ, недостаточный для элиминации вируса и вирусинфицированных клеток. Во-вторых, вирус может пассивно или активно уклоняться от взаимодействия с эффекторами иммунитета, прежде всего с цитотоксическими Т-лимфоцитами. Иными словами, антииммунитетная стратегия вирусов может иметь профилактическую направленность (подавление индукции иммунного ответа) или проявляется после того, как хозяин уже накопил определенный запас антивирусных средств (подавление реализации иммунного ответа).
Подавление индукции иммунного ответа. Идеальный способ для исключения иммунного ответа — полная блокада вирусных генов, персистирующих внутри клетки: молчащие гены не вызывают синтеза белков, и, следовательно, клетка не будет мечена вирусными антигенами. Но в таком случае вирус лишился бы экологического пресса, перестав эволюционировать. Отсюда любой вирус, претендующий на закрепление в природе, обязан полностью или частично реплицироваться, а персистенция — лишь хорошее подспорье для того, чтобы рано или поздно проявить свой репликативный потенциал.
Одним из примеров стабилизации вирусного инфекта на фоне ослабления иммунной реакции является внутриутробное инфицирование, создающее прецедент для негативной селекции (элиминации) незрелых Т-лимфоцитов, коммитированных против вируса. Это вызывает толерантность, т.е. иммунологическую ареактивность против вируса. Такая возможность обсуждается в связи с трансплацентарным заражением вирусом гепатита В (HBV), которое в 90% случаев ведет к хроническому вирусоносительству; у взрослых острый гепатит В завершается персистенцией вируса лишь в 10% случаев. Врожденная HBV-инфекция сочетается с ослаблением ответа на нуклеокапсидные HBV-эпитопы; cпособность к образованию антител против поверхностного антигена (HBsAg) сохраняется (см. «Вирусы гепатита»).
Относительная толерантность к вирусным антигенам возникает и у взрослых. Замечено, например, что при хроническом гепатите В количество анти-HBV CTL гораздо меньше, чем у больных острым гепатитом, а их противоантигенный (точнее, противоэпитопный спектр) значительно сокращен. Причиной может быть истощение антивирусных Т-клонов избытком вирусных антигенов или разрушительная аутоагрессия против СТL с фиксированными на их поверхности вирусными пептидами (результат связывания свободных HBV-пептидов молекулами HLA-1).
Другим механизмом может быть недостаточная презентация вирусных антигенов в системе главного комплекса гистосовместимости. Обладая высоким полиморфизмом, молекулы HLA отличаются по сродству к различным пептидам и способности представлять их Т-лимфоцитам. Это означает, что индивиды с разным HLA-фенотипом могут неодинаково реагировать на один и тот же вирус. В реальных ситуациях, когда в реакцию втягивается множество антигенных эпитопов и Т-клонов, влияние подобного фактора на иммунный ответ маловероятно, но это может иметь значение, если речь идет о реактивности к наиболее важным (протективным) антигенам. Значимость такого механизма возрастает и при слабом иммунном ответе, для которого характерна олигоклональность, т.е. вовлечение в реакцию ограниченного числа лимфоцитарных клонов на лимитированный спектр эпитопов. Это довольно типично для хронических вирусных инфекций.
Но вирусы способны и активно блокировать презентацию собственных антигенов. Они добиваются этого, снижая экспрессию HLA и других иммуновспомогательных молекул на поверхности зараженных клеток. По примерным подсчетам, для индукции Т-ответа требуется 200 HLA-пептидов; за этим порогом клетки незаметны для Т-лимфоцитов. Способность к сокращению числа молекул HLA обнаружена у аденовирусов, цитомегаловируса, вируса Эпстайна—Барр. Эффект может быть непрямым. В этом случае он опосредован через подавление секреции или блокаду цитокинов, стимулирующих экспрессию антигенпредставляющих молекул, а также через ослабление чувствительности вирусинфицированных клеток к такого рода медиаторам. Это установлено для вируса гепатита В: его кор-антиген (HBcAg) снижает синтез альфа-интерферона, а ДНК-полимераза подавляет клеточные реакции на альфа- и гамма-интерфероны. То же самое известно для нуклеокапсидного белка вируса гепатита С, который вызывает значительное подавление альфа-интерферона у больных хроническим гепатитом С.