Содержание
Современные тесты позволяют фиксировать наличие антигена без вторичных проявлений иммунохимических реакций. Это методы первого уровня, обладающие максимальной чувствительностью. Сюда относятся иммунофлюоресцентный, радиоиммунный и иммуноферментный (иммуноэнзимный) анализы. Наиболее широко используется твердофазный вариант иммуноферментного анализа, в котором антигены вылавливаются антителами, фиксированными на полистироловом планшете, а затем проявляются (в прямой или непрямой аранжировке) мечеными антителами (рис. 3).
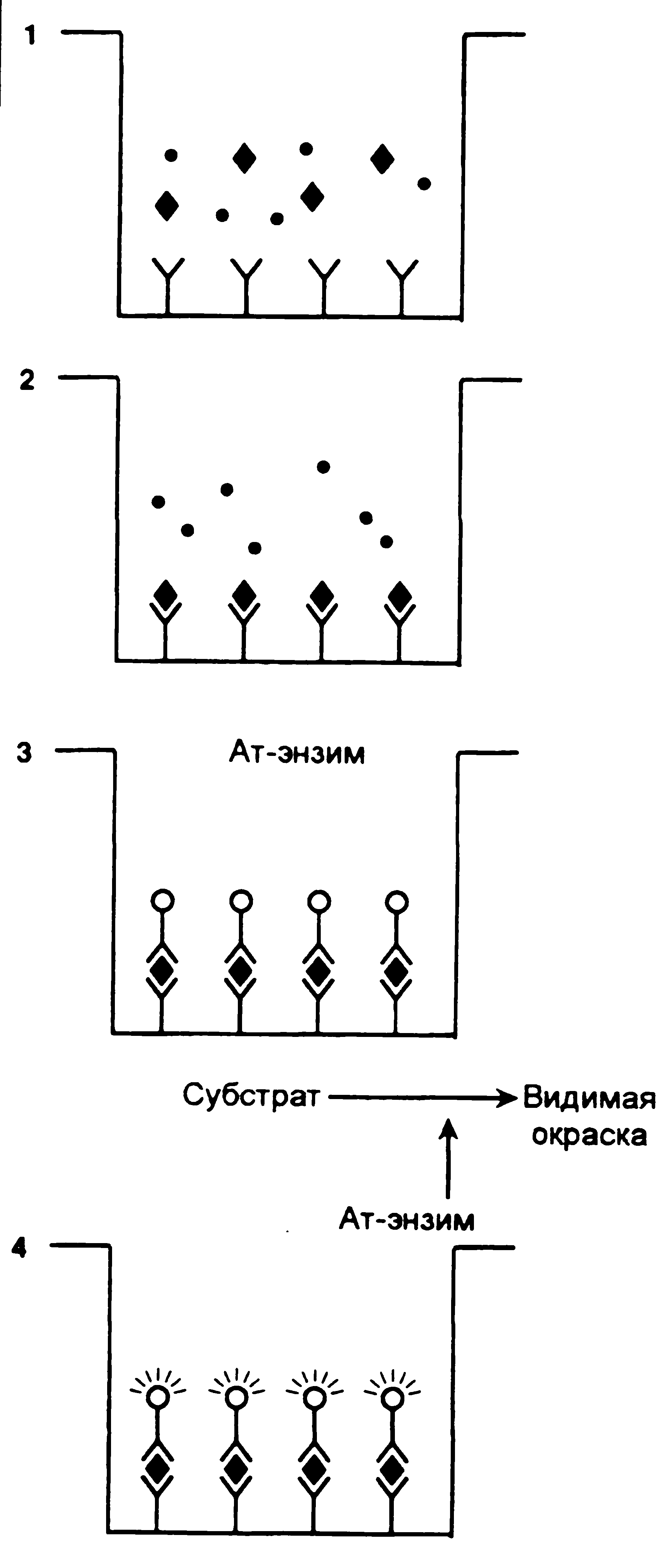
Специфичность иммунохимического анализа повышает применение моноклональных антител на каждом из этапов реакции. Как уже говорилось, это повышает избирательность взаимодействия антител с антигеном, так как моноклональные антитела связываются с единственным эпитопом.
Специфические микробные метаболиты. Фенотипическое своеобразие микробов проявляется и в особенностях их токсического и ферментативного профиля. Поэтому определение данных показателей в исследуемом материале может оказаться полезным в диагностике инфекционного процесса. Примером служит выявление Helicobacter pylori у больных с пептическими язвами желудка и 12-перстной кишки. Дело в том, что H. pylori, обитающий в слизистой оболочке желудка, выделяет мощную уреазу — фермент, который, превращая мочевину в аммиак и углекислый газ, нейтрализует окружающую кислую среду. Определение уреазы является оптимальным методом диагностики хеликобактерной инфекции, так как содержимое желудка не содержит других бактерий, обладающих уреазной активностью. Для этого можно обследовать биопсийный материал, но эндоскопия является небезопасной процедурой и к тому же (если материал получен неадекватно) может дать ложноотрицательный результат. Этих недостатков лишен респираторный тест с мочевиной. Обследуемый принимает с пищей мочевину, меченную радиоактивным углеродом. Под влиянием уреазы из нее выделяется углекислый газ, который после всасывания в кровь выделяется легкими. Его регистрируют в выдыхаемом воздухе, начиная с первых минут после приема мочевины. Метод высоконадежен, так как отражает суммарную метаболическую активность бактерий независимо от места колонизации.
Нуклеиновые кислоты. Развитие молекулярной генетики позволило установить еще один класс взаимокомплементарных молекул — нуклеиновые кислоты, считываемые в клетке в процессе репликации и транскрипции. Стремление к повышению качества диагностических манипуляций инициировало принципиально новый подход к индикации микроорганизмов. Он базируется на обнаружении нуклеиновых кислот, точнее их фрагментов, специфичных для каждого вида микроорганизмов. Фактически речь идет об идентификации генов, своеобразие которых определяется последовательностью четырех пурин-пиримидиновых оснований, детерминирующих различные фенотипические признаки.
Все тесты, основанные на манипуляциях с нуклеиновыми кислотами, можно разделить на две группы: выявление генов при помощи фрагментов ДНК (РНК), добавляемых к исследуемому материалу, и варианты цепной реакции, предназначенные для амплификации генов, т.е. для их искусственной репликации in vitro.
Гибридизация. Двойная спираль ДНК построена из дискретных нитей, удерживаемых вместе водородными связями между комплементарными основаниями (аденин—пурин, гуанин—цитозин). Водородные связи отличаются непрочностью, поэтому двухцепочечная ДНК может быть разделена на одиночные нити при нагревании до 95—100оС. Если температуру понизить, то в результате случайных молекулярных взаимодействий комплементарные нити реассоциируют, образуя двухспиральную молекулу. Это происходит только в тех случаях, когда обе нити представляют гомологичную (генетически родственную) пару. Из каждой нити ДНК можно выбрать и искусственно синтезировать короткий фрагмент (зонд), который будет взаимодействовать только с комплементарной для себя последовательностью ДНК-мишени. Это служит основой для высокоспецифичных гибридизационных тестов, предназначенных для строго избирательного выявления молекул ДНК по наличию в них последовательностей, гомологичных известным ДНК-зондам.
Так как последовательности, из которых складываются дискретные гены, кодируют все структурные и функциональные признаки микроорганизмов, всегда удается отыскать (а затем синтезировать) уникальные последовательности нуклеотидов, специфичные для определенной группы микробов. Более того, гибридизационные тесты не ограничены спариванием ДНК-ДНК; стабильные гибриды образуются и в системах ДНК-РНК и РНК-РНК. Например, для гибридизации часто используется 16S рибосомальная РНК, которая по последовательности нуклеотидов отличается у разных видов и представлена тысячами идентичных копий в каждой клетке в отличие от фенотипически значимых генов, для большинства которых имеется единственная копия.
Технически гибридизационные тесты сводятся к следующему. Одноцепочечный ДНК-зонд метится изотопом, ферментом или любой другой легко распознаваемой меткой. Исследуемый материал обрабатывают в режиме, позволяющем разрушить микроорганизмы, высвободить и денатурировать ДНК, т.е. расчленить ее на одиночные нити. После инкубации зонда с исследуемым образцом измеряют количество меченой ДНК, связавшейся (вступившей в гибридизацию) с нуклеиновыми кислотами тест-препарата. Обычно перед добавлением меченого ДНК-зонда нуклеиновые кислоты исследуемого материала фиксируют на твердофазных сорбентах. Это позволяет легко удалить несвязанные меченые зонды путем отмывания. Но реакцию можно проводить и в растворе. В этом случае образовавшиеся комплексы ДНК (зонд—мишень) избирательно фиксируются на специальных сорбентах после завершения гибридизации.
Для получения положительного результата исследуемые образцы должны содержать несколько тысяч микробов. Чувствительность повышается после подращивания в культуре. Например, некоторые ДНК-вирусы удается идентифицировать в тканевых культурах до проявления цитопатического эффекта. Точно также ДНК-гибридизация существенно ускоряет обнаружение микобактерий, для получения видимых колоний которых требуется потратить 4—6 нед, а затем еще несколько дней на идентификацию. Объективности ради заметим, что в подобных случаях хорошо срабатывают и серологические тесты, выявляющие микробные антигены.
Полимеразная цепная реакция (ПЦР). Чувствительность микробиологического анализа, основанного на выявлении нуклеиновых кислот, можно многократно (теоретически неограниченно) повысить путем их амплификации, т.е. мультикопирования специфических фрагментов ДНК in vitro. Речь пойдет о классическом варианте цепной амплификации, который широко используется в современной диагностике инфекционных заболеваний.