Содержание
Апоптоз. В отличие от цитолиза, который всегда пассивен, возникая при грубых повреждениях плазматической мембраны, апоптоз является активным, генетически запрограммированным отмиранием клеток. Есть факты, позволяющие думать, что изменение соотношений между ростовыми и апоптозными потенциями клеток влияет на цитопатический эффект вирусов. Гиперэкспрессия апоптозных генов усиливает гибель, тогда как блокада апоптозной программы стимулирует рост и размножение, вызывая гиперпролиферацию (онкогенную трансформацию) клеток.
Известно более десятка вирусных генов, которые кодируют факторы, усиливающие апоптозный процесс. Обнаружены они и у вирусов человека (аденовирусы, герпесвирусы, папилломавирусы, вирусы гриппа, ВИЧ-вирусы, вирус гепатита В и др.). В ряде случаев апоптоз коррелирует с усилением экспрессии р53 — гена, претендующего на одну из ключевых позиций в индукции апоптоза. Гибель клеток удается предотвратить при помощи продукта протоонкогена bcl-2, усиливающего клеточную пролиферацию. Предложена гипотеза, согласно которой гибель CD4 Т-лимфоцитов при ВИЧ-инфекции связана с апоптозом. Пусковым фактором служит взаимодействие вирусного суперкапсидного гликопротеина gp120 с CD4-рецепторами лимфоцитов — сигнал, запускающий апоптозный механизм подобно рецепторзависимому апоптозу в системах Fas-FasL и ТНФ-ТНФR. Пока это единственный пример такого рода; в остальных случаях для индукции апоптоза требуется проникновение вируса в клетку и хотя бы частичная экспрессия его генома.
Опережающая смерть клетки, несущей зачаток вируса — исход, выгодный скорее хозяину, чем вирусу. Неслучайно об этом говорят, как об альтруистическом самоубийстве, подразумевая, что клетка предпочитает погибнуть, исключив возможность размножения потенциально опасного вируса. Логика подсказывает, что вирусы должны обладать и альтернативным механизмом, который, продлевая жизнь клеток, создавал бы условия для воссоздания как можно более многочисленного вирусного потомства в литическом цикле или обеспечивал переход вируса в латентное состояние (персистенцию). Действительно, некоторые вирусы способны блокировать апоптозный ответ на собственную инфекцию. Это достигается разными способами, но их принцип сводится к двум механизмам — повышение экспрессии антиапоптозных (ростстимулирующих) генов клетки и инактивация эффекторных молекул апоптоза. К первой группе можно отнести стимуляцию протоонкогенов типа bcl-2 (это, в частности, наблюдается при персистенции вируса Эпстайна—Барр в В-лимфоцитах), ко второй — блокаду Р53, продукта апоптозного гена р53 (Е6 протеин вируса папилломы человека — см. «Папилломавирусы»).
Образование симпласта (синцития). Феноменология сводится к слиянию нескольких клеток с образованием поликариона — многоядерной нежизнеспособной клетки. Образование симпласта характерно для сложных (оболочечных) вирусов и обусловлено рецепторзависимой цитотропностью суперкапсидных белков. Симпласт образуется двумя способами — внешним и внутренним (рис. 3).
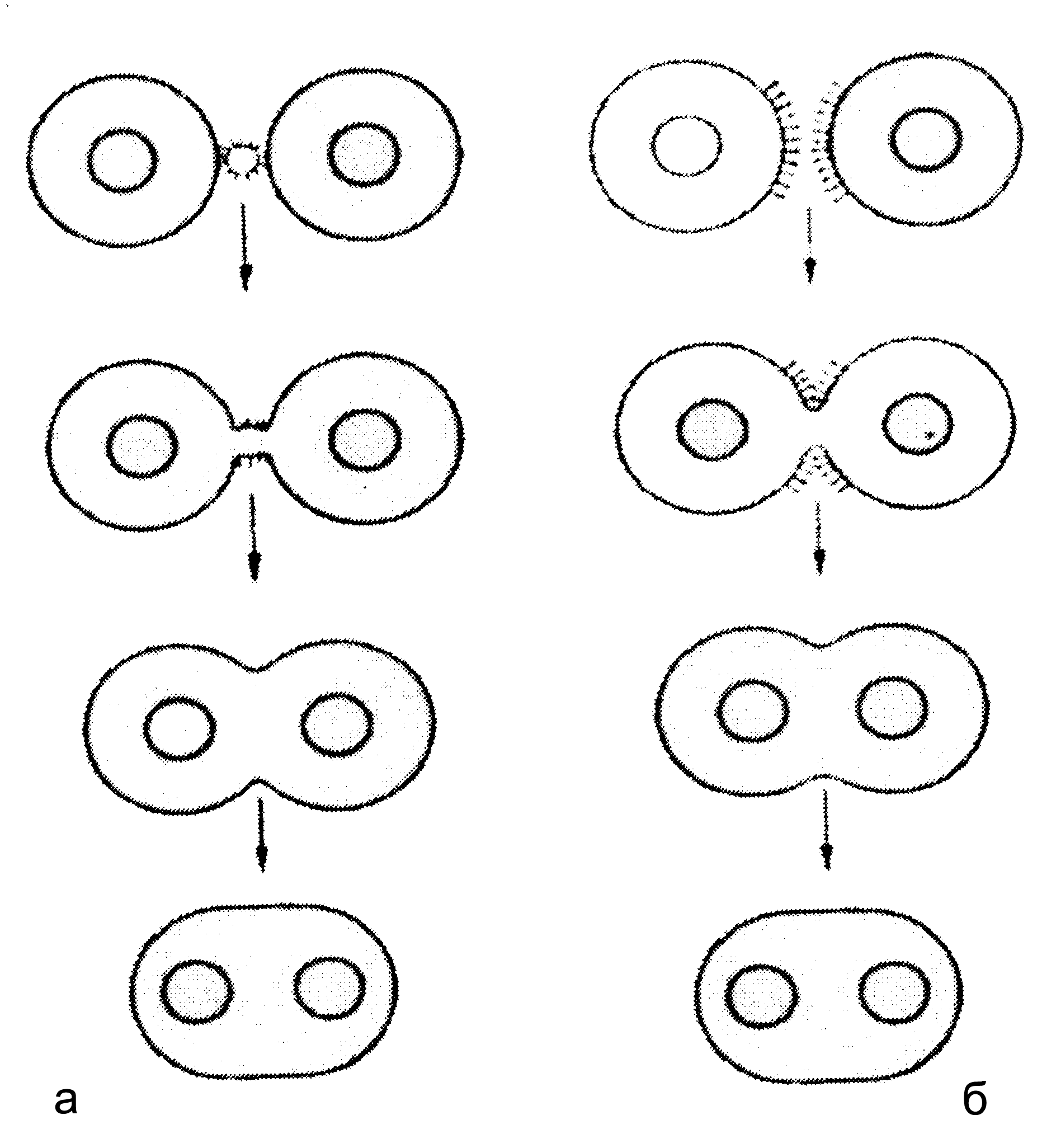
Слияние снаружи описано для парамиксовирусов (возбудители кори, парагриппа, паротита, респираторно-синцитиальный вирус) и наблюдается при множественном заражении благодаря одновременному взаимодействию вируса (вириона) с несколькими клетками. Это вызывает их агрегацию, а затем слияние клеточных мембран. И то и другое не требует синтеза вирусных белков, проявляясь в первые часы после заражения клеточных культур. Слияние изнутри — более универсальный процесс, известный для многих оболочечных вирусов. В этом случае образованию симпласта предшествует синтез и включение вирусных белков в клеточные мембраны. Такие белки рецептируются соседними клетками, индуцируя их агрегацию. Феномен возникает при низкой дозировке инфекта и выявляется на поздних этапах репликации.
Опосредованная цитопатогенность. Гибель клеток связана не только с прямым воздействием вируса. В этом могут быть повинны и эффекторы иммунитета, атакующие зараженные клетки (см. «Механизмы противоинфекционного иммунитета»). Сложные (оболочечные) вирусы образуют суперкапсид из клеточных мембран, заблаговременно встраивая в них собственные компоненты. Но экспрессируются и антигены, представляющие глубинные элементы вириона, и даже функциональные белки, которые не входят в состав вирусных частиц. Они выныривают на поверхность клеток в комплексе с молекулами главного комплекса гистосовместимости — HLA. Клетки, экспрессирующие вирусные эпитопы, несут на себе отпечаток чужеродности, превращаясь в мишень для антител и Т-лимфоцитов. Фиксируясь на зараженных клетках, антитела подключают к цитолизу комплемент и клетки-эффекторы, располагающие рецепторами к иммуноглобулинам (макрофаги, естественные киллеры, нейтрофилы). Это хорошо моделируется in vitro, но действительное отношение антителозависимых реакций к поражению вирусинфицированных клеток остается неясным. Впрочем, антитела реально претендуют на участие в патогенезе вирусных инфекций благодаря другому механизму — иммунокомплексному воспалению. При гиперпродукции вирионов (антигенов) и антител образуется избыток циркулирующих иммунных агрегатов, которые оседают на базальных мембранах микрососудов и, активируя комплемент, вызывают острое воспаление. Особенно опасно поражение почек — гломерулонефрит, который иногда осложняет вирусные инфекции.
В этом отношении поучительна история с вирусом лимфоцитарного хориоменингита (ЛХМ). Его главный природный резервуар — мелкие грызуны, а самый распространенный источник инфекции для человека — мыши. ЛХМ взрослых мышей не отличается от ЛХМ человека, протекая как острая инфекция с преимущественным поражением ЦНС. Иной результат дает заражение новорожденных мышей. В большинстве они не только не погибают, но остаются внешне здоровыми, поддерживая персистенцию вируса. Лишь позже (не ранее 6-месячного возраста) у части мышей появляются признаки заболевания, но совсем иного, чем у остроинфицированных взрослых животных. В этом случае доминируют симптомы хронического иммунокомплексного поражения почечных клубочков — смертельного гломерулонефрита. Дело в том, что новорожденный организм иммунологически толерантен к вирусу, позволяя ему беспрепятственно размножаться. Вирус ЛХМ лишен прямой цитотоксичности, и его репликация сама по себе не ведет к патологии. Но образование антител, которое постепенно набирает силу, ведет к появлению иммунных комплексов, запускающих патологический процесс. Мыши, которые после рождения сохраняют ареактивность к вирусу, превращаются в пожизненный резервуар инфекции.
Изучение ЛХМ преподнесло еще один сюрприз. Если взрослых мышей заразить в мозг высокой дозой вируса ЛХМ, а через несколько дней ввести иммунодепрессант (например, циклофосфамид), большинство из них выживает, хотя размножение вируса продолжается. Напротив, если новорожденным мышам-вирусоносителям инокулировать в брюшную полость лимфоциты мышей, иммунных к ЛХМ, они быстро погибают от острого менингита в результате Т-опосредованного цитопатического эффекта. Т-лимфоциты вызывают гибель зараженных клеток, индуцируя цитолиз или апоптоз. При активации они секретируют цитокины (гамма-интерферон и др.), которые привлекают и стимулируют макрофаги, побуждая их к разрушительным действиям.
Все это необходимо для реализации противовирусной резистентности (подробнее об этом см. «Механизмы противоинфекционного иммунитета»). Здесь мы лишь вновь обращаем внимание на диалектику подобных реакций. При гиперболизации (особенно если вирус обладает слабой вирулентностью) они обретают болезнетворность, поддерживая цитопатический процесс. Значение этого механизма реально при вирусных инфекциях, патогенез которых не удается связать с прямой цитотоксичностью возбудителя, как это было продемонстрировано на модели вируса ЛХМ.
Трансформация. Под трансформацией понимается появление клеток с опухолевыми (онкогенными) потенциями. Такие клетки обретают бессмертие (возможность неограниченно долго перевиваться in vitro) и склонность к бесконтрольной пролиферации. В классическом варианте трансформация обусловлена активацией генов пролиферации (онкогенов, или протоонкогенов) — нормального атрибута генетического аппарата всех клеток. Некоторые вирусы несут собственные онкогены, хотя в анамнезе многие из них тоже имеют клеточное происхождение.
Большинство трансформирующих вирусов человека и животных относятся к ДНК-вирусам, обладая способностью встраивать свои гены в хромосомы инфицированной клетки. Это характерно для непермиссивных клеток, которые благодаря этому избегают деструктивного действия вирусов. Другим вариантом является заражение дефектными вирионами (см. ниже). В таких условиях экспрессируется ограниченное число вирусных генов, в том числе таких, продукты которых нарушают регуляцию клеточного цикла, инактивируя один или несколько супрессорных белков (например, Rb, p53). Именно в этот момент, т.е. в период ослабления митотического процесса, наиболее вероятны спонтанные и индуцированные мутации.