Содержание
Токсичность ЛПС и эндотоксиноподобных продуктов грамположительных бактерий намного ниже и проявляется в условиях, обеспечивающих всасывание значительной порции токсических веществ. Впрочем, есть примеры катастрофического повышения чувствительности к ЛПС. Это моделируется в знаменитом феномене Шварцмана — диссеминированной, обычно смертельной коагулопатии после повторного (через 24 ч) введения ЛПС. Вместо ЛПС для разрешающей инъекции могут быть использованы другие продукты бактериальной и небактериальной природы, что отражает неспецифическую природу реакции и широкий спектр сенсибилизирующей активности эндотоксинов. Добавим, что ЛПС усиливают токсичность скарлатинозного токсина и, возможно, других суперантигенов (см. ниже).
В проекции на инфекционный процесс можно говорить о токсинах, которые определяют клиническую картину заболевания, и о токсинах, не имеющих четкой патогенетической доминанты. К первым из них относятся токсины дифтерийной палочки, холерного вибриона, клостридий, вызывающих столбняк и ботулизм, возбудителя сибирской язвы, энтеротоксигенных энтеробактерий, некоторых стафилококков и стрептококков. Токсинов второго типа гораздо больше. Их называют «парциальными токсинами» или «токсинами частного приложения», подразумевая, что, действуя раздельно, они не определяют специфики патологического процесса.
Кроме того, в интоксикации принимают участие вторичные токсины, которые выделяются при повреждении или активации клеток хозяина, что особенно характерно для ЛПС, вызывающих гиперсекрецию флогогенных цитокинов из стимулированных макрофагов и других клеток. Наведенным токсическим эффектом обладают суперантигены, неспецифически стимулирующие Т-лимфоциты (см. ниже).
Названия экзотоксинов традиционно базируются на категории поражаемых мишеней, хотя это не всегда совпадает с масштабом патогенетического эффекта. Ниже приведена терминология, которая с известной долей условности отражает биологическую активность бактериальных токсинов.
Энтеротоксины — поражают эпителий (энтероциты) тонкого кишечника; иногда под эту рубрику попадают токсины, проникающие через кишечник, но не оказывающие на него прямого действия (например, энтеротоксины золотистого стафилококка).
Нейротоксины — вызывают избирательное поражение нервных клеток, межнейронных и нервно-мышечных синапсов.
Дермонекротоксины — поражают кожу. К этой весьма расплывчатой группе относятся эксфолиатины золотистого стафилококка, обладающие уникальной способностью разрушать эпителиальные десмосомы (см. «Стафилококк»).
Гемолизины — лизируют эритроциты. Определение нельзя понимать буквально, так как цитотоксичность гемолизинов не ограничивается лизисом эритроцитов, распространяясь на другие типы клеток. Эритроциты — лишь удобная модель для изучения цитолитического эффекта.
Лейкоцидины — антифагоцитарные факторы, повреждающие лейкоциты (нейтрофилы), иногда макрофаги.
Цилиотоксины — факторы возбудителей респираторных инфекций, вызывающие цилиарную дискинезию, цилистаз и цилиотоксичность (например, трахеальный токсин B. pertussis, пневмолизин S. pneumoniae).
Суперантигены — неспецифические (поликлональные) стимуляторы лимфоцитов, прежде всего Т-лимфоцитов. В отличие от моноклональной (антигензависимой) активации, в реакцию вовлекается множество клонов лимфоцитов, что ведет к гиперсекреции цитокинов и синдрому вторичной (цитокинопосредованной) интоксикации. Свойствами суперантигенов обладают энтеротоксины и токсины токсического шока стафилококка, скарлатинозный токсин стрептококка, антигены микоплазм и др. Известны суперантигены, которые неспецифически стимулируют В-лимфоциты, вызывая поликлональный синтез иммуноглобулинов.
Избирательность токсического эффекта определяется спецификой клеточных рецепторов. Некоторые из токсинов воспринимаются ганглиозидами цитоплазматической мембраны (энтеротоксин холерного вибриона, нейротоксины клостридий, вызывающих столбняк и ботулизм). Т-суперантигены обретают активность после связывания с молекулами главного комплекса гистосовместимости (HLA-2) макрофагов, действие ЛПС-эндотоксинов опосредовано через рецепторы макрофагов для сывороточных белков (ЛПС-связывающий белок, производные комплемента). Для многих токсинов природа рецепторов не установлена.
По механизму действия можно выделить несколько групп токсинов:
1. Токсины, действующие на цитоплазматическую мембрану. Структурное повреждение мембран и лизис клеток-мишеней вызывают фосфолипазы (например, альфа-токсин Clostridium perfringens), детергенты (альфа-токсин Staphylococcus aureus), факторы, агрегирующие холестерол (О-стрептолизин Streptococcus pyogenes). Повреждение может быть функциональным, ограничиваясь нарушением активности мембранных ферментов. Иногда это смертельно для клетки, хотя и не сопровождается цитолизом. Например, лейкоцидин золотистого стафилококка токсичен для нейтрофилов, так как, повышая проницаемость для Са2+, дестабилизирует внутриклеточный ионный баланс.
2. Внутриклеточные токсины. Внедряются в клетку, атакуя внутриклеточные мишени. Этому обычно предшествует активация токсина — ограниченный протеолиз и восстановление внутримолекулярных тиоловых связей. При активации от молекулы отщепляется фрагмент, который проникает в клетку, оказывая каталитическое действие. Структуру таких токсинов (бинарные токсины) описывают формулой А-В, где «В» выполняет рецепторную функцию, а «А» отвечает за токсичность.
Один из универсальных каталитических эффектов — АДФ-рибозилирование ключевых ферментов клетки. Принцип сводится к отщеплению аденозиндифосфата (АДФ-рибозы) от никотинамидадениндинуклеотида (НАД) и его присоединению к белку-мишени. Полагают, что специфические ингибиторы АДФ-рибозилирования могут составить новую группу высокоактивных антагонистов микробных токсинов.
Токсины этого типа (точнее их А-фрагмент) являются бифункциональными ферментами, действуя как НАД-гидролазы и АДФ-рибозилтрансферазы. Суммарно реакция выглядит следующим образом: 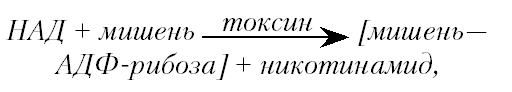
где «мишень» и «мишень—АДФ-рибоза» — функционально активный и инактивированный токсином внутриклеточный фермент.
А-фрагменты бинарных токсинов обладают еще одним важным свойством — высокой избирательностью катализа. Попав в клетку, каждый из них находит собственную мишень, модифицируя строго определенные ферменты. В сочетании со спецификой связывания В-фрагмента это объясняет особенности биологического эффекта разных токсинов. Например, дифтерийный токсин инактивирует (АДФ-рибозилирует) фактор элонгации-2, нарушая сборку пептидов на рибосомах. Энтеротоксин холерного вибриона (холероген) модифицирует белок (G-белок), блокирующий аденилатциклазу энтероцитов; это ведет к повышению внутриклеточного уровня циклического аденозинмонофосфата (цАМФ), гиперсекреции изотонической жидкости в тонком кишечнике и дегидратации организма. Кстати, известны токсины, обладающие прямой аденилатциклазной активностью (один из минорных токсинов коклюшной палочки, отечный фактор токсина сибиреязвенных бацилл). Они извращают функции клеток, нарушая внутриклеточный гомеостаз по цАМФ.
Разновидностью внутриклеточных токсинов являются нейротоксины клостридий, вызывающих столбняк и ботулизм. Их тропизм к нервной ткани определяется ганглиозидными рецепторами нейронов и нервных окончаний. При столбняке токсин (тетаноспазмин) образуется в ране и после связывания окончаниями периферических нервов достигает спинного мозга путем ретроградного внутриаксонального транспорта. В спинном мозге он воспринимается регуляторными нейронами, блокируя секрецию ингибиторных нейротрансмиттеров — глицина и гамма-аминобутировой кислоты. Это вызывает перевозбуждение моторных нейронов, приводя к стойким мышечным контрактурам — спастическим параличам. Ботулинический токсин поступает с пищей, контаминированной клостридиями. Он устойчив к протеолитическим ферментам пищеварительного тракта и после всасывания в кровь достигает нервно-мышечных синапсов, где связывается рецепторами пресинаптической мембраны двигательных нервов, блокируя секрецию ацетилхолина. Это обрывает нервные импульсы, приводя к необратимой релаксации мышц — вялым параличам (см. «Клостридии»).
3. Контактные (инъекционные) токсины. Известно около 20 эффекторных белков, действующих по контактному типу. Их спектр продолжает расширяться вследствие большого интереса ученых к функциональным последствиям адгезии.
К инъекционным токсинам можно отнести белки грамотрицательных бактерий (энтеробактерии, псевдомонады и др.), которые вводятся в клетку при адгезивных контактах благодаря механизму секреции типа III. В случае нефагоцитирующих (эпителиальных) клеток их действие может быть направлено на перестройку актинового цитоскелета, которая подготавливает поглощение бактерий (шигеллы, сальмонеллы) подобно инвазинам наружной мембраны (йерсинии). Энтеропатогенные и энтерогеморрагические эшерихии секретируют белок (Tir/EspE), который включается в плазматическую мембрану клеток и, связывая специальный адгезин (итимин), служит рецептором для усиления адгезии. Еще одним эффектом является запуск апоптозной программы клеток. Это замечено для штаммов Shigella, Yersinia, Salmonella и Pseudomonas, которые убивают фагоциты, впрыскивая в них факторы, активирующие каспазный цикл. Сальмонеллы способны усиливать свое выживание в макрофагах, продуцируя контактные токсины, блокирующие слияние фагосом и лизосом.
4. Модулины. Так называются микробные факторы, действующие опосредованно, через медиаторы воспаления и иммунитета. Это связано с тем, что при контакте с фагоцитами, лимфоцитами и другими клетками они побуждают к продукции цитокинов/хемокинов, которые отвечают за токсический эффект. Одной из молекулярных мишеней служат TLR-рецепторы клеток (от англ. toll like receptor), которые передают сигнал через систему транскрипционных факторов (прежде всего через NF-kB) на генетический аппарат клетки, стимулируя экспрессию цитокиновых генов.