Содержание
H. pylori прикрепляется к клеткам многих тканей. Однако в условиях естественной инфекции он отдает явное предпочтение эпителию гастрального типа. Так, в 12-перстной кишке бактерии заселяют зоны гастральной метаплазии; прилежащие к ним клетки интестинального типа не колонизируются. Соответственно, в желудке H. pylori избегает участков слизистой оболочки с интестинальной метаплазией, т.е. с эпителием кишечного типа. Бактериальные факторы, определяющие адгезию, точно не установлены, хотя имеется несколько кандидатов среди фибриллярных (пилеподобных) структур с гемагглютинирующей активностью. Они связываются с мембранными гликолипидами, протеогликанами, сиалированными ламинином (входящим в состав межклеточных контактов и базальной мембраны) компонентами слизи. Эффект специализированных адгезинов усиливается липополисахаридом наружной мембраны. Впрочем, по аналогии с некоторыми видами хеликобактеров животного происхождения закрепление на эпителиоцитах может быть не обязательным условием для колонизации слизистой оболочки. Бактерии способны персистировать в слое слизи, покрывающей эпителий (первичная адгезия). Инвазия нехарактерна, и лишь единичные бактерии подвергаются эндоцитозу, сохраняясь внутри эпителиоцитов.
Специфика адгезинов не исчерпывает комплекса факторов, определяющих высокую избирательность H. pylori в отношении человека. Подобно другим бактериям, важнейшим фактором роста для хеликобактеров является железо. Они добывают его непосредственно из лактоферрина мукоидного секрета, используя для этого лактоферринсвязывающий белок наружной мембраны. Лактоферриновые рецепторы H. pylori обладают удивительным свойством: фиксируя человеческий лактоферрин, они не взаимодействуют с аналогичным белком животных. Это лишний раз подчеркивает, что базисные условия для своего развития H. pylori получает только в организме человека.
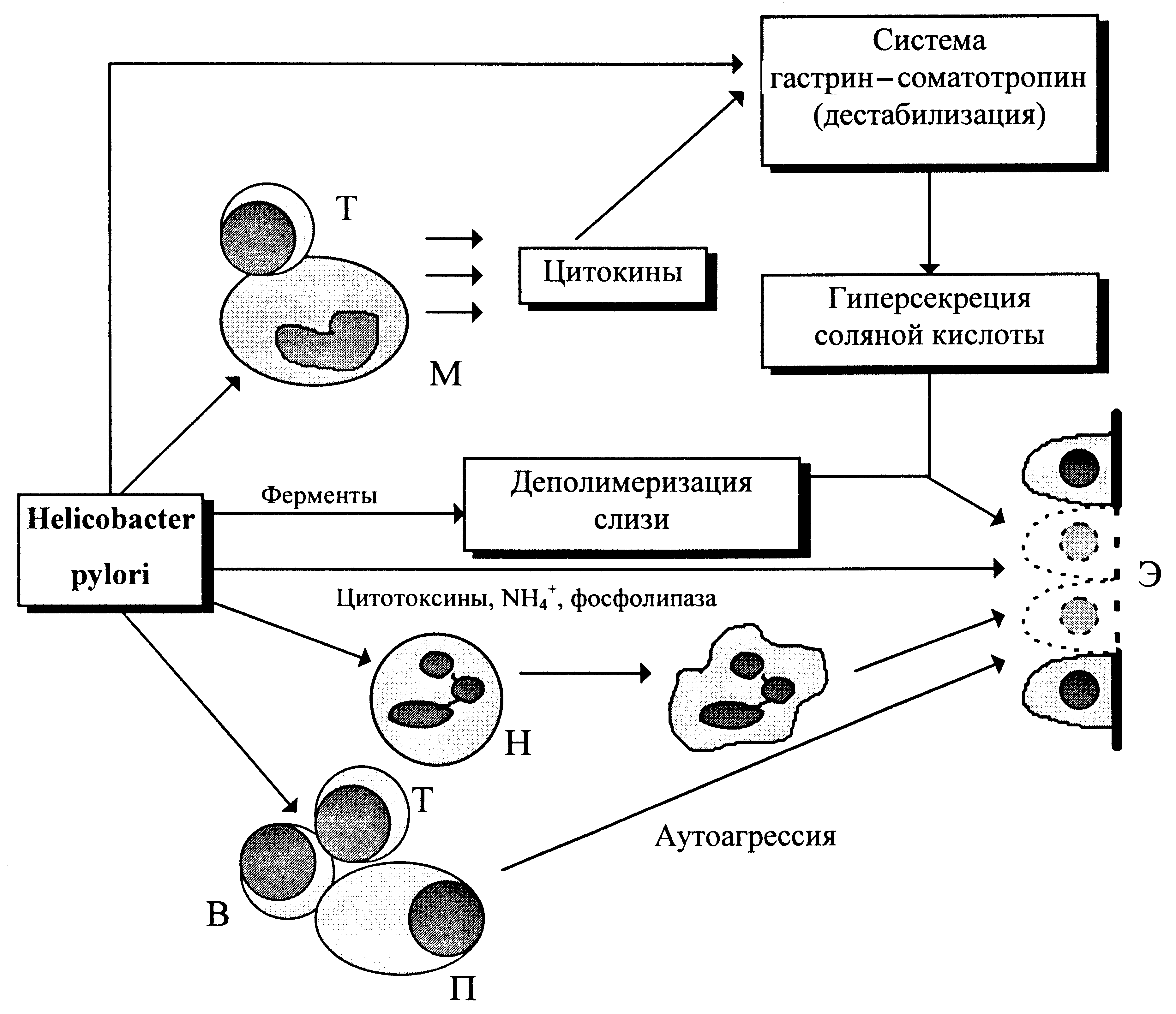
Обосновавшись на слизистой оболочке, H. pylori начинает продуцировать факторы, которые запускают и поддерживают воспалительную реакцию в стенке желудка. Имеется прямая корреляция между количеством бактерий на слизистой оболочке и интенсивностью воспалительной реакции. Сама зона колонизации (т.е. поверхность инфицированной слизистой оболочки) остается вне сферы действия воспалительных клеток, которые локализуются в субэпителиальном слое слизистой оболочки. Это позволяет бактериям ускользать от прямой атаки, способствуя их персистенции. H. pylori обладает комплексом факторов, активирующих нейтрофилы, эпителиальные клетки, моноциты и Т-лимфоциты. Кроме того, в очаге воспаления выделяются флогогенные медиаторы (интерлейкины-1, -6, -8, туморонекротический фактор, гамма-интерферон, фактор активации тромбоцитов и пр.), которые поддерживают воспалительный процесс.
Деструкция слизистой оболочки с развитием язвенных поражений происходит сравнительно редко, и ее пусковые механизмы гипотетичны. У H.pylori обнаружены токсины, повреждающие эпителиоциты in vitro. Но они продуцируются не всеми штаммами, выделяемыми от больных с язвенной патологией, и их патогенетическое значение требует дополнительных обоснований. Это, в частности, справедливо для вакуолизирующего (VacA) и CagA (англ. cytotoxin-associated antigen) токсинов. Их продукция колеблется между штаммами и не может отвечать за всю вирулентность. То же самое справедливо для факторов с антипролиферативной активностью, которые, возможно, ослабляют репарацию поврежденного эпителия. Приводятся доводы в пользу цитотоксичности фосфолипазы и продуктов уреазной активности (аммония). Установлено деполимеризующее действие ферментов H. pylori на слизь, покрывающую эпителий желудка. Истончение слоя слизи делает эпителиоциты более уязвимыми для соляной кислоты.
В целом, главной остается классическая трактовка, согласно которой возникновение пептических язв связано с действием соляной кислоты на фоне снижения регенеративных потенций эпителия и факторов, нейтрализующих кислотное содержимое желудка. Вопрос лишь в том, каким образом H. pylori помогает индукции и реализации данного механизма. Можно, в частности, думать о суммарном воздействии микробных и эндогенных факторов, тем более, что в биоптатах из зоны активной язвы 12-перстной кишки H. pylori обнаруживается лишь у 15,9—56% больных. Это ставит под сомнение приоритет микробных продуктов в прямом повреждении эпителия, побуждая к более сложным патогенетическим схемам. Допускается, например, что H. pylori прямо или косвенно (через цитокины и другие медиаторы воспаления) влияет на физиологическое равновесие в системе клеток слизистой оболочки желудка, секретирующих соматотропин, гастрин и соляную кислоту. Возникающий дисбаланс в секреции соляной кислоты в сочетании с предрасполагающими (в том числе микробными) факторами ведет к повреждению слизистой оболочки.
Среди возможных причин тканевой деструкции рассматриваются и нейтрофилы. H. pylori побуждают к продукции хемоаттрактантов поли- и мононуклеарных фагоцитов, которые (прежде всего интерлейкин-8) выделяются мукозальными эпителиоцитами при контакте с живыми H. pylori, особенно с cag-позитивными вариантами. Из водных экстрактов бактериальных клеток и продуктов метаболизма выделен белок, который усиливает интегринзависимое взаимодействие нейтрофилов с эндотелиоцитами и стимулирует их кислородзависимый метаболизм. Признаки активации нейтрофилов отмечаются непостоянно и не у всех больных (это может быть связано с особенностями хеликобактерных штаммов), но в ряде случаев эпителий подвергается агрессии со стороны оксидантов, катионных белков и протеолитических ферментов стимулированных нейтрофилов. Это создает опасность изъязвления, а при частом и длительном повторении — атрофии эпителиоцитов.
Предложена и иммунологическая концепция хеликобактерной патологии. H. pylori располагает антигенами, которые перекрестно реагируют с эпителиоцитами слизистой оболочки желудка, что допускает образование аутоантител и аутоагрессивных Т-лимфоцитов. Однако иммунопатогенетическая (аутоиммунная) трактовка деструктивного процесса не может быть принята для объяснения язвенного поражения 12-перстной кишки, так как ее эпителиоциты лишены общих эпитопов с антигенами H. pylori. Иммунопатогенетическая гипотеза встречает и другое возражение: развитие язвенного процесса обычно обрывается вместе с элиминацией H. pylori, тогда как однажды индуцированный аутоиммунный процесс должен был бы иметь продолжение. С этой точки зрения значение аутоиммунных реакций выглядит более логичным для атрофического гастрита. В целом H. pylori вызывает широкий спектр реакций иммунитета — от элементов острого (нейтрофилзависимого) воспаления до местных и системных реакций гуморального и клеточного иммунитета. Они недостаточны для элиминации H. pylori, но контролируют его взаимоотношения с хозяином, и, возможно, участвуют в эволюции патологического процесса. Различные факторы не исключают друг друга, но могут действовать вместе как уникальный патогенетический каскад, одним из пусковых механизмов которого служит хеликобактерная инфекция (рис. 2).