Содержание
О1-групповые штаммы (классический и Эль-Тор) имеют антигенные детерминанты А, В и С, которые делают возможным их дальнейшее типирование. Сочетание АВ-субъединиц называется субтипом Огава, АС — серотипом Инаба, АВС (встречается редко) — серотипом Хикошима (рис. 2). Эти особенности используются в эпидемиологических исследованиях для определения сходства или различия штаммов, спровоцировавших холеру. V. cholerae О139 очень похож на серовар О1, что допускает его происхождение от биотопа Эль-Тор. Подобно другим не-О1 холерным штаммам, он образует капсулу, которая скорее всего не участвует в болезнетворном процессе.

V. cholerae является короткой, слегка искривленной, высоко подвижной грамотрицательной палочкой. У него один полярно расположенный Н-жгутик, который серологически идентичен у всех холерных вибрионов. По липополисахаридному О-антигену холерные вибрионы разделяют более чем на 150 серотипов (серогрупп), которые можно отличить не только по этому признаку, но и по генотипическим деталям, отражающим степень вирулентности. По мере обнаружения новых О-серотипов возникло противоречие, связанное с признанием того, что холеру вызывают представители лишь одного О-серотипа V. cholerae — О1. Пришлось принять компромиссное решение — оставив неизменным название вида (V. cholerae), остальные штаммы именовать не-О1-серотипами, или неагглютинирующимися. Оказалось, что не-О1-штаммы способны вызывать диарейные (даже холероподобные) инфекции у человека (спорадические и небольшие вспышки) за счет плохо понятных факторов, не связанных с продукцией холерного энтеротоксина. Более того, с 1992 г. началось пандемическое распространение холеры, связанной с энтеротоксигенным штаммом О139 V. cholerae, который, выйдя из южной части Индийского полуострова, обрел черты эпидемичности.
V. cholerae не образует спор. Поэтому он весьма чувствителен к физическим и химическим агентам. Погибает при умеренно высоких температурах (10 мин при 55оС) и столь же легко уничтожается обычными дезинфектантами. Факультативный анаэроб со склонностью к аэробным условиям существования. Восстанавливает нитраты в нитрит, и это служит стимулом для анаэробного роста при наличии ферментируемого субстрата, например глюкозы или сахарозы. Вообще, подобно другим вибрионам, V. cholerae отличается неприхотливостью и может быть выращен на обычной пептонной воде. Негалофилен, или галотолерантен, что означает его способность выживать и развиваться на средах, не содержащих или включающих до 3% NaCl. Оксидазоположителен, что отличает V. cholerae от энтеробактерий, которые тоже выделяются из кишечника человека и животных. Оптимальная температура роста — 30—37оС, но размножение может быть получено в диапазоне от 16 до 42оС. Это служит лимитирующим фактором для накопления V. cholerae в окружающей среде (прежде всего в воде), способствуя сезонности холерных эпидемий. Продуцирует комплекс экстрацеллюлярных ферментов, которые расщепляют ДНК, желатин, хитин, белок, лецитин, утилизируют крахмал и многие углеводы (сбраживание до кислоты). Это сближает V. cholerae с другими вибрионами, родами Aeromonas и Plesiomonas (которые тоже способны вызывать заболевания у человека) и больше годится для взаимоотношений с внешней средой, чем с человеком.
В патогенезе инфекции серьезную роль играет повышенная чувствительность V. cholerae к кислотам и несколько необычная резистентность к щелочам и солям желчных кислот. Во-первых, это требует от холерного вибриона высокой дозировки для того, чтобы преодолеть кислую среду нормального желудка и инициировать инфекцию. Во-вторых, способствует выживанию бактерий, оказавшихся в условиях повышенного содержания солей желчных кислот и щелочной среды слизистой тонкого кишечника. Относительная толерантность холерных вибрионов к высоким рН (до 9,6) и таким ингибиторам бактериального роста, как тиосульфат, соли желчных кислот и теллурит, широко используется в приготовлении селективных питательных сред для культивирования холерного вибриона. Холерные вибрионы составляют первую группу (из шести) по Хейбергу, т.е. разлагают маннозу и сахарозу, но инертны к арабинозе. В предварительной идентификации V. cholerae ключевым шагом служит позитивный оксидазный тест: он отличает их от энтеробактерий, загрязняющих водоемы.
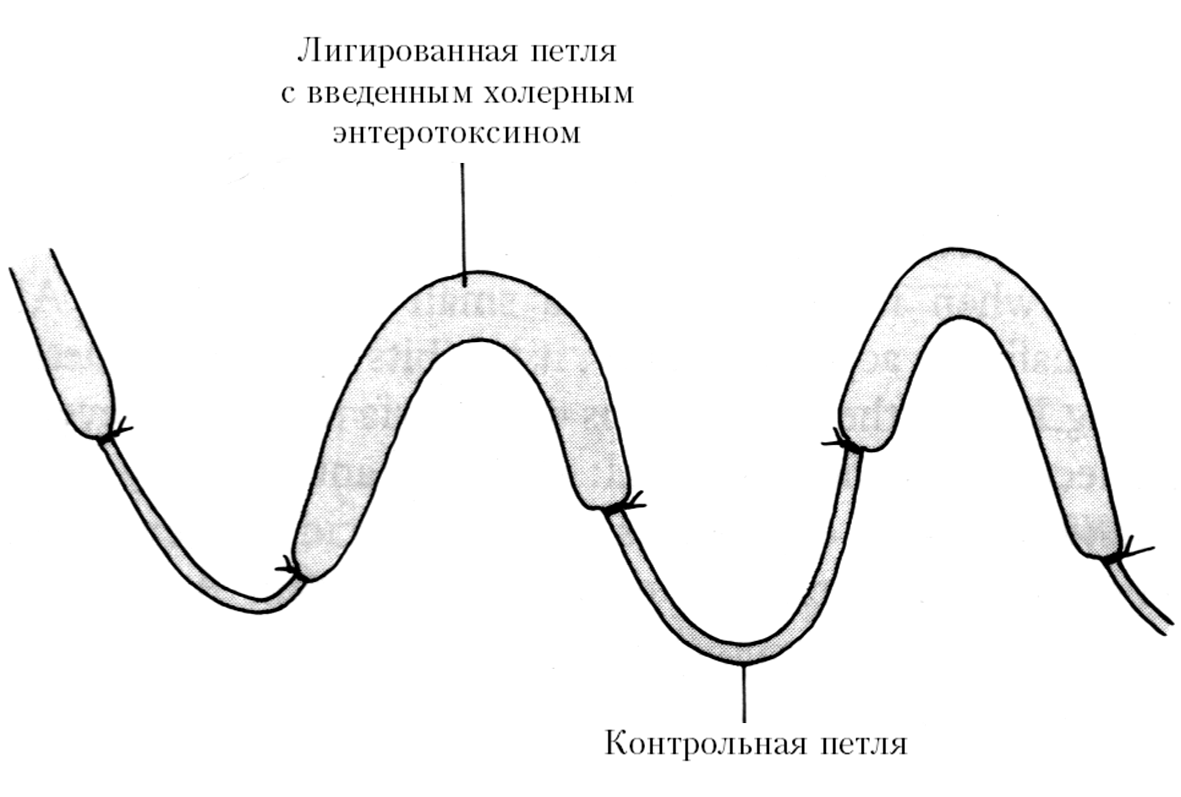
Патогенез холеры — сложный процесс, который зависит от комплекса факторов, обеспечивающих колонизацию эпителия (энтероцитов) тонкого кишечника и продукцию энтеротоксина, разрывающего ионный транспорт в интестинальных клетках. Хотя образование холерного токсина, закодированного в ctxAB-генах (англ. cholera toxin, A и В субъединицы токсина), напрямую связано с явлениями диареи, развитие холеры возникает вследствие синергического эффекта многих генов, включая гены колонизационных факторов, прежде всего tcp (англ. toxin coregulated pili). Кстати, холерный энтеротоксин был открыт лишь в 1959 г. на основе теста с изолированной кишкой кролика в независимых опытах De и Dutta (рис. 3). До этого считалось, что главным в патогенезе холеры является эндотоксин, всасывающийся в кровь из кишечника.
Основные гены вирулентности находятся в трех хромосомных кластерах (островах патогенности), два из которых привносятся в клетку при помощи умеренных нитевидных бактериофагов. Сегодня известно, что координированная экспрессия генов ctxAB и tcp контролируется в составе регулона тремя регуляторными генами toxS, toxT и toxR, среди которых последний является глобальным геном-регулятором. Отсутствие или повреждение гена toxR у штаммов, имеющих структурные гены ctxAB и tcp, обусловливает авирулентность или слабую вирулентность V. cholerae, резко (более чем в 100 раз) снижая продукцию холерного энтеротоксина и токсинкорегулируемых пилей. Присутствие в геноме вибрионов указанных генов и их эффективная экспрессия обеспечивают развитие инфекционного процесса при заражении человека.
Ген tcp (точнее его главный компонент tcpА) рассматривается как инициирующий элемент в каскаде генов tcp-острова патогенности. Его экспрессия определяет синтез TCP-пилей, которые являются ведущим фактором микробной колонизации человека. Кроме того, ТСР-пили служат рецептором для фага, вносящего гены холерного токсина (CTX), создавая условия для горизонтального приобретения этого важнейшего атрибута холерного вибриона. Полагают, что такой обмен может происходить внутри тонкого кишечника, где создаются оптимальные условия для взаимодействия бактерий с лизогенными фагами. Важно, что многие клинические изоляты V. cholerae O1 и О139 несут множество копий СТХ и, следовательно, ctxAB-оперонов. Это повышает вирулентность штаммов, делая их более агрессивными.
Молекула холерного токсина состоит из белковых субъединиц, которые собираются вместе в периплазматическом пространстве — одной А и пяти В. Компонент В служит рецептором токсина, связываясь с GM1-гликозидами на поверхности эпителиальных клеток тонкого кишечника. Оказавшись внутри энтероцитов, холерный токсин высвобождает свою субъединицу А (точнее А1) и находит молекулярную мишень (белок Gs), действие на которую ведет к холерной диарее. Этот эффект происходит в результате АДФ-рибозилирования Gs-белка, как это наблюдается при действии дифтерийного токсина на фактор элонгации EF-2 (см. «Возбудитель дифтерии»). Такой механизм лишает Gs-белок гуанинтрифосфатазной активности, снимая контроль с торможения аденилатциклазы. Создается повод для бесконтрольного синтеза циклического аденозинмонофосфата (цАМФ) и через это — к извращениям в обмене электролитами и потере воды.