Содержание
Наиболее известны два эшерихиозных энтеротоксина — термолабильный (LT) и термостабильный (ST). Они закодированы в плазмидах — дискретных или общих. В последнем случае оба токсина синтезируются одновременно (около 5% штаммов).
LT-токсины образуют примерно 25% штаммов ЭТКП. По механизму действия (АДФ-рибозилтрансфераза) и даже по антигенным свойствам они похожи на холерогены — энтеротоксины холерного вибриона. После рецепции ганглиозидами энтероцитов LT-токсин (точнее, его А-субъединица) проникает в клетку и инактивирует (АДФ-рибозилирует) регуляторный белок, контролирующий активность аденилатциклазы. Диареегенный эффект связан с повышением внутриклеточного уровня циклического аденозинмонофосфата (рис. 2).
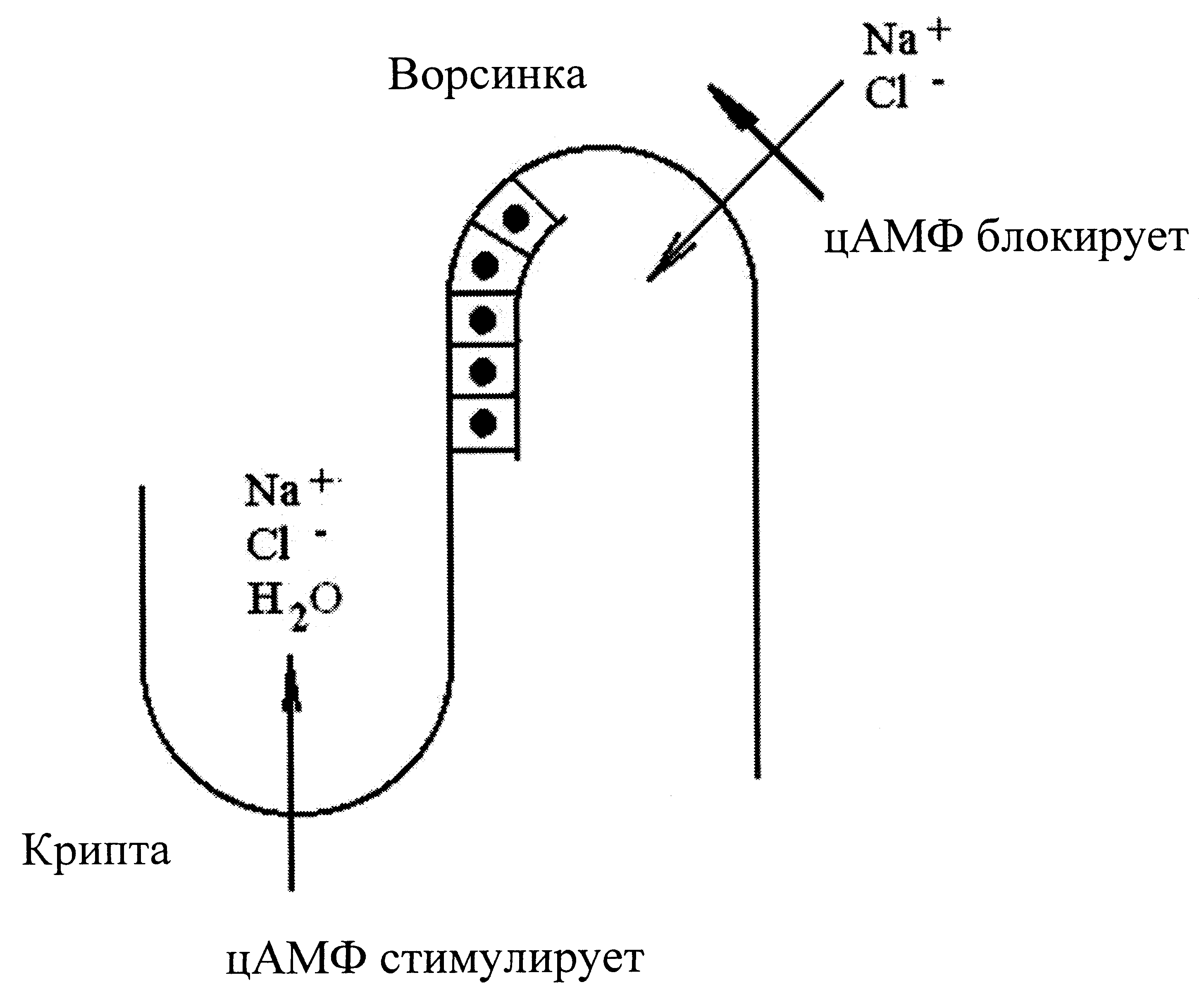
ST-токсин (его продуцируют около 70% штаммов ЭТКП) выглядит и действует иначе, хотя с патогенетической точки зрения делает «общее дело». Он состоит из двух низкомолекулярных пептидов (StA и StB), которые обладают слабой иммуногенностью и устойчивы к прогреванию, протеолитическим ферментам и кислотам. Токсин не проникает в клетку, действуя на рецепторы энтероцитов, связанные с мембранной гуанилатциклазой. Усиление синтеза циклического гуанозинмонофосфата нарушает внутриклеточный баланс по циклическим нуклеотидам, провоцируя гиперсекрецию воды и электролитов.
Токсинообразованию предшествует закрепление ЭТКП на энтероцитах, особенно проксимальных отделов тонкого кишечника. Это требует нестандартной атрибутики, которой лишены обычные кишечные палочки, населяющие толстый кишечник. Среди факторов, обеспечивающих избирательную колонизацию энтероцитов, лучше всего изучены CFA/I, CFA/II и CFА/IV (от англ. colonization factor antigens). Они экспрессированы примерно на 75% человеческих ЭТКП, примерно поровну распределены между ЭТКП-штаммами и представляют собой лектины, структурно оформленные в виде пилей/фимбрий (рис. 3).
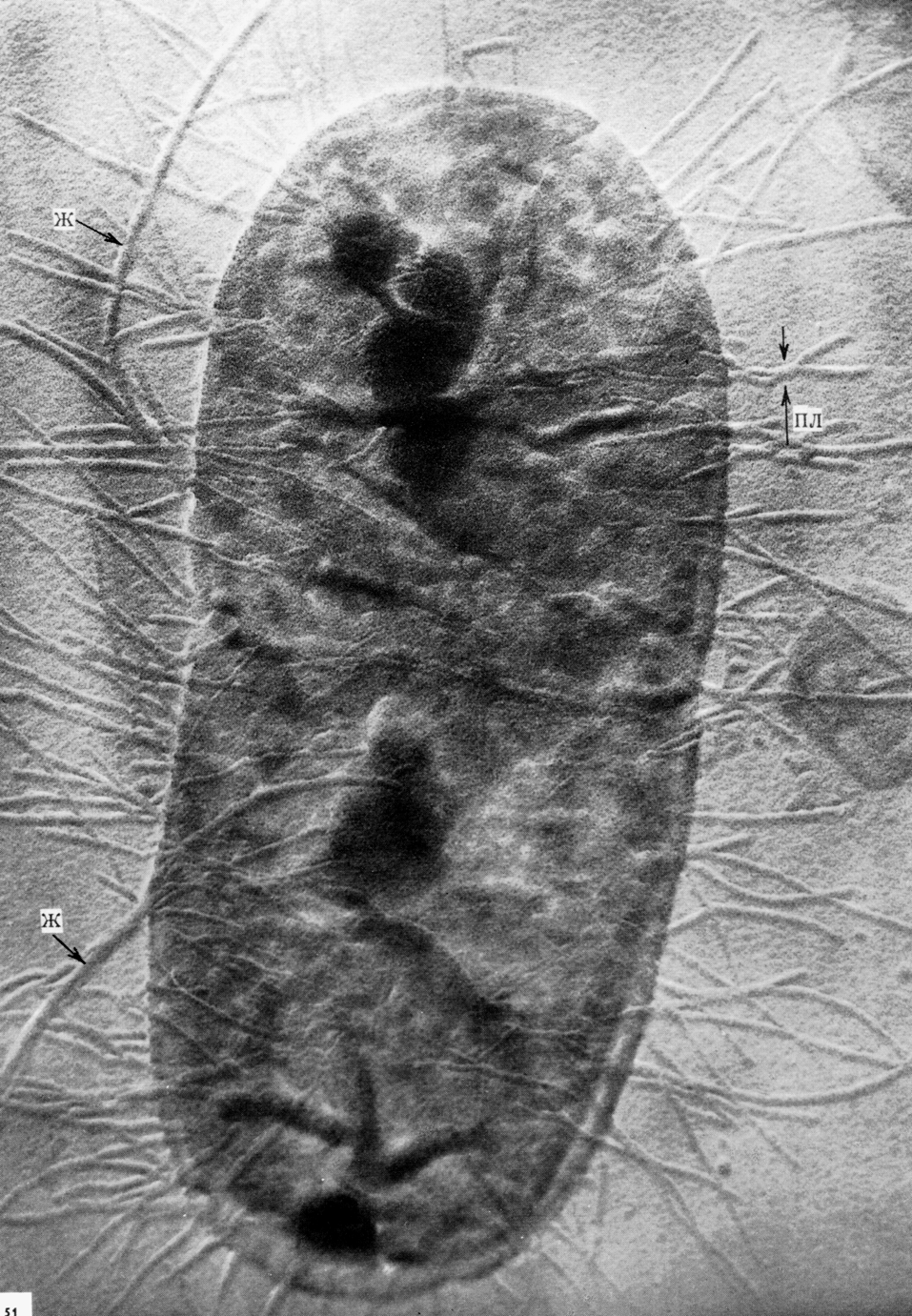
По одной из классификаций принято дифференцировать маннозочувствительные и маннозорезистентные адгезины эшерихий. Первые взаимодействуют с маннозными радикалами гликопротеинов и поэтому блокируются маннозой и ее производными, вторые — не реагируют с маннозой. CFA маннозорезистентны, что выделяет их из обширного арсенала фимбрий и нефимбриальных факторов, задействованных в банальной колонизации толстого кишечника. В отличие от них CFA воспринимаются теми же клеточными ганглиозидами (GM1), которые фиксируют LT-токсины. Заметим, что фимбрии ЭТКП животных (К88, К89, 987Р) тоже резистентны к маннозе, хотя и не идентичны адгезинам человеческих ЭТКП. Это объясняет причину антропонозности энтеротоксигенных коли-инфекций: ЭТКП животных не способны колонизировать тонкий кишечник человека, что, кстати, справедливо и для других категорий диареегенных эшерихий (см. ниже). Энтеротоксины ЭТКП человека и животных структурно тоже не идентичны, хотя и близки по механизму действия. Кстати, CFА/II и CFА/IV сами по себе неоднородны. Каждый из них состоит из трех антигенов — CS1, CS2, CS3 (CFA/II) и CS4, CS5, CS6 (CFA/IV) (от англ. cell surface). CFА/I структурно гомогенен.
CFA закодированы в плазмидах по соседству с генами энтеротоксинов, и лишь одновременная экспрессия cfa- и tox-генов обеспечивает ЭТКП-вирулентность. Без колонизирующих факторов энтеротоксины патогенетически инертны точно так же, как CFA-адгезины без токсигенности. Изучение факторов колонизации продолжается. К этому побуждают наблюдения за штаммами ЭТКП, лишенными CFA: они составляют около 20% выделяемых культур.
Энтеропатогенные кишечные палочки (ЭПКП). С них в 1950-х гг. стартовал современный этап в изучении диареегенных эшерихий. Этим объясняется неудачный универсализм термина (энтеропатогенность), который в равной мере можно распространить на все диареегенные эшерихии. ЭПКП, к которым относятся представители около 20 О-серогрупп (чаще О55, О111, О119, О127, О128), вызывают поражение тонкого кишечника у детей младшего возраста (до двух лет, обычно на первом году жизни). Ранее заболевание именовалось токсической диспепсией.
ЭПКП поражают тонкий кишечник. В основе диарейного синдрома лежит феномен сглаживания эпителиальных микроворсинок на фоне интимной адгезии между бактериями и эпителиальной плазматической мембраной. Это сопровождается образованием пьедесталоподобной структуры из-за аккумуляции филаментозного актина и других цитоскелетных элементов, таких как a-актинин, талин, эзрин и легкая цепь миозина (рис. 4). Драматичная потеря адсорбирующих ворсинок в зоне, прилегающей к месту адгезии ЭПКП, ведет к диарее за счет нарушения электролитного баланса и мальабсорбции.
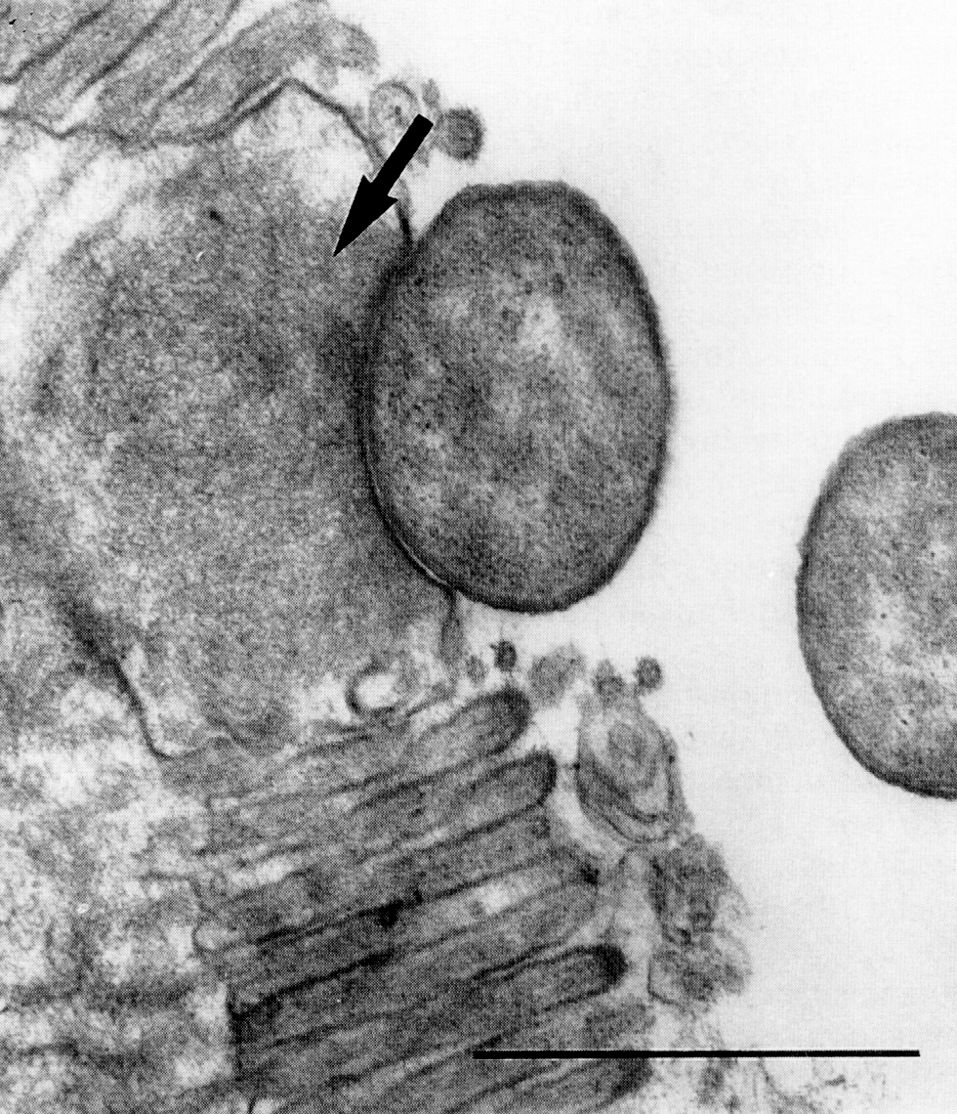
Расшифровка этого явления занимает одну из ключевых позиций в изучении патогенетических взаимоотношений между бактериями и клетками хозяина, затрагивая такие важные сюжеты, как природа адгезивных контактов, секреция III типа, функции эффекторных белков, перестройка внутриклеточного гомеостаза и пр. Патогенез ЭПКП-инфекции можно представить следующим образом. Попав в кишечник, ЭПКП начинают экспрессировать комплекс молекул, необходимых для закрепления бактерий на энтероцитах, и cинтеза белков, составляющих основу секреции типа III, — фимбрии (Bfp, от англ. bundle-forming pili), интимин, Tir (от англ. translocated intimin receptor), наружные белки (EspA, EspB, EspD). После адгезии ЭПКП впрыскивают в клетку эффекторные белки, которые активируют сигнальные каналы, вызывая изменения клеточного цитоскелета, выражающиеся в деполимеризации актина и потере микроворсинок. Заключительный этап возникает вслед за фосфорилирующей активацией Tir, включенного в плазматическую мембрану, и утратой первичных (Bfp- и EspA-зависимых) контактов между ЭПКП и энтероцитом. Интимин связывается с модифицированным Tir, приводя к интимной адгезии за счет образования массивного пьедестала из филаментозного актина и других компонентов цитоскелета в зоне бактериальной адгезии. Еще один эффектор, Мар (от англ. mitochondrial-associated protein), нацелен на митохондрии, производя разрыв мембранного потенциала. Нарушению интестинального барьера способствуют и другие факторы (EspF и др.), которые повреждают межклеточную интегративность, вызывая гибель клеток. Следует добавить еще один механизм ЭПКП-инфекции — воспалительный синдром, который сводится к трансмиграции нейтрофилов в зону поражения в ответ на цитокины (хемокины), секретируемые пораженными энтероцитами. Воспаление не очень значительно, хотя принципиально отличает ЭПКП от диареи секреторного типа, вызываемой ЭТКП.
Но это лишь общие представления. Имеется немало исключений, связанных с атипичными ЭПКП. Они требуют дополнительных исследований для правильного понимания механизмов болезни и разработки адекватных подходов к диагностике детских диарей.
Энтероинвазивные кишечные палочки (ЭИКП) вызывают синдром, практически не отличимый от шигеллезной дизентерии — диарею инвазивного типа (кровянистые испражнения с примесью слизи и лейкоцитов). Подобно шигеллам, ЭТКП проникают и размножаются в эпителиоцитах толстого кишечника и, повреждая их, индуцируют воспаление и изъязвление слизистой оболочки. Энтероинвазивность ограничена представителями нескольких О-групп: О28, О112, О124, О136, О143, О144, О152, О164. Они отвечают за небольшой процент всех случаев бактериальной дизентерии, значительно уступая шигеллам. Но этого достаточно, чтобы сделать проблему ощутимой в абсолютном исчислении, особенно при низком уровне санитарной культуры. ЭИКП обычно поражают детей — спорадически или в виде вспышек в организованных коллективах. Взрослые страдают редко — во время водных или пищевых вспышек.