Содержание
Папилломавирусы инфицируют многослойный плоский эпителий, что определяет спектр поражаемых мишеней — эпидермис кожи и слизистые оболочки, покрытые эпителием такого типа. Заражению подвергаются клетки базального (зародышевого) слоя. Это недифференцированные, активно пролиферирующие клетки, которые обеспечивают непрерывное обновление эпителиального пласта. Дозревая по мере продвижения на поверхность, они утрачивают способность к делению, и в конце концов сбрасываются в окружающую среду. В эпидермисе это сочетается с ороговением, т.е. превращением клеток в кератиновые чешуйки, лишенные ядра и цитоплазматических органелл.
Особенность (возможно, уникальность) папилломавирусов состоит в том, что созревание вирионов зависит от дифференцировочного процесса клеток (см. рисунок). В зародышевом слое вирус лишь закрепляет свой генетический материал, который реплицируется синхронно с хромосомами и передается в виде эписомных копий дочерним клеткам. Синтез вирусных белков начинается в шиповидных клетках, а сборка вирионов (она происходит в клеточном ядре) достигает пика в зернистом слое эпителия.
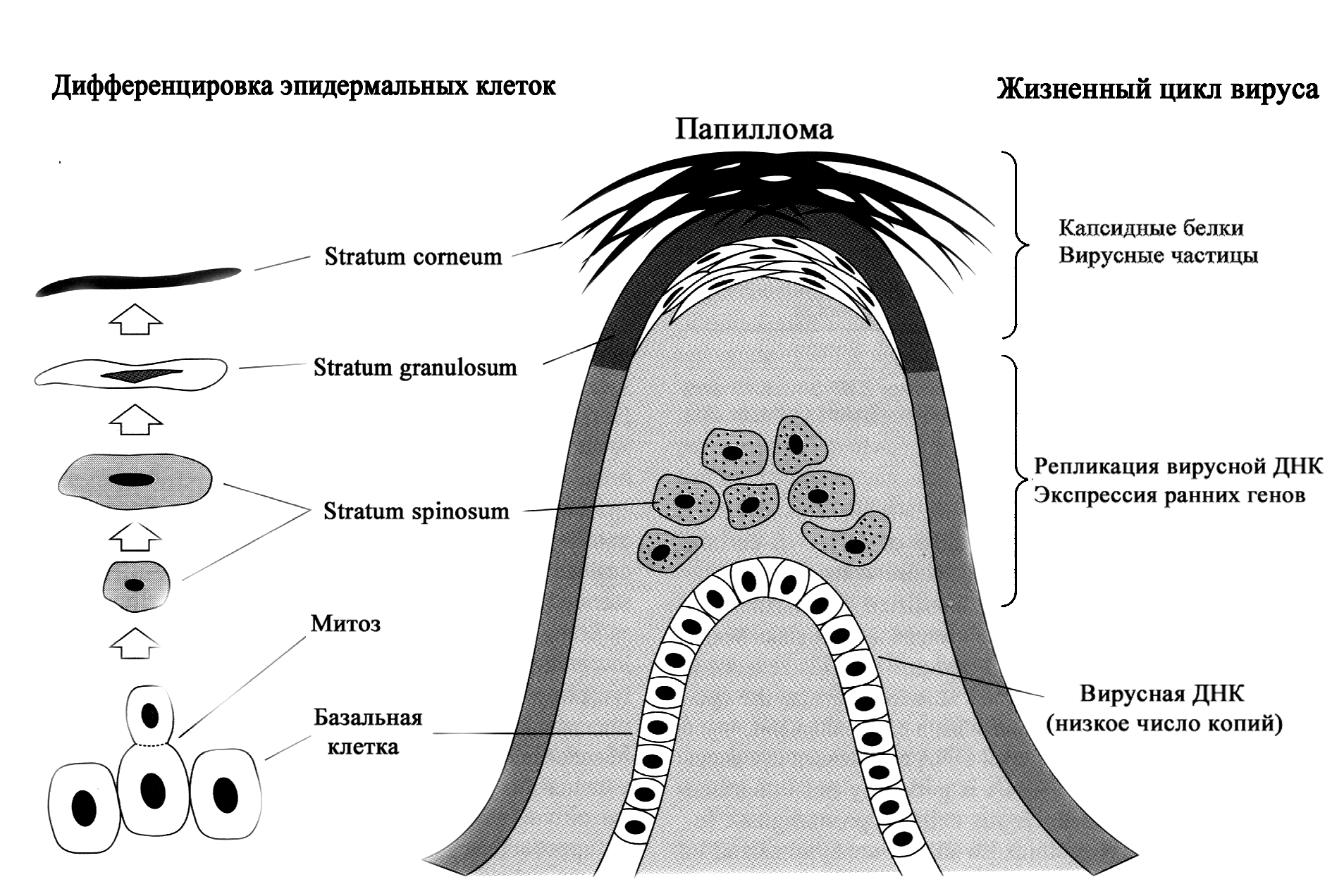
Принципиально, что речь идет о зависимости продуктивной репликации именно от дифференцировочного процесса, а не от степени зрелости клеток как его промежуточного или финального этапа. Этим, в частности, объясняются трудности культивирования папилломавирусов. Нужны не просто дифференцированные эпителиоциты, а клетки, находящиеся в процессе дифференцировки, причем заражение должно произойти на фоне высокой пролиферативной активности клеток. Только в таких условиях удается поддерживать продуктивную инфекцию папилломавирусов в клеточных культурах in vitro.
Вирус достигает базального слоя эпителия через микротравмы эпидермиса или слизистых оболочек. К числу вероятных клеточных рецепторов относятся гепарансульфат и a6-интегрин, хотя разные HPV-типы в этом отношении не одинаковы. Оказавшись в клетке, вирусная ДНК транслоцируется в ядро, где происходят основные события. Как уже говорилось, продуктивная репликация возможна лишь в клетках, вступивших на путь необратимой дифференцировки. В противном случае инфекция принимает абортивный характер. Вирусный геном элиминируется или начинает персистировать, используя механизм неинтегративной и/или интегративной вирогении; последнее характерно для малигнизированных клеток (см. ниже).
Зависимость от факторов дифференцирующихся, но утративших способность к пролиферации эпителиоцитов ставит перед вирусом непростую задачу. Для репродукции ему необходимы транскрипция и репликация ДНК, которые целиком зависят от пролиферативного потенциала клетки-хозяина. Но теряя митотическую активность, эпителиоциты прекращают синтез ферментов, поддерживающих пролиферацию. Вирус решает эту проблему, навязывая клетке пролиферативную активность, т.е. возвращает ее способность к образованию необходимых для себя транскрипционных и репликативных факторов. В этом суть репликативной стратегии и причина онкогенности папилломавирусов.
Сочетание клеточной пролиферации с дифференцировочным процессом характерно для доброкачественных опухолей (бородавки). Малигнизация останавливает процесс созревания эпителиоцитов, наделяя их злокачественной (инвазивной) агрессивностью. Если при доброкачественном росте пролиферирующие клетки не выходят за пределы эпителия (интраэпителиальный рост), то злокачественная дисплазия сочетается с пенетрацией базальной мембраны, знаменуя начало метастазирования.
Ранние HPV-белки обладают полифункциональностью. Она основана на их способности к взаимодействию с различными клеточными белками и регуляторными сайтами HPV-генома (LCR). Вопреки нумерации, репликация начинается с образования белков Е6 и Е7. Это происходит под влиянием клеточных факторов, которые связываются с LCR, запуская транскрипцию вирусных генов. Белки Е6 и Е7 реанимируют клеточный цикл, побуждая к синтезу факторов, необходимых для транскрипции и репликации ДНК. Главными мишенями служат два ключевых противоопухолевых белка, р53 и р105-RB. Они контролируют деление клеток, останавливая митотический цикл в G1-фазе. Е6 взаимодействует с р53, делая его чувствительным к убиквитинзависимой деградации. Кроме того, Е6 связывается еще с несколькими белками, функции которых не известны . Е7 действует через рRB, точнее через семейство RB-белков. Комплексирование с рRB ведет к высвобождению транскрипционного фактора E2F-1. Он обеспечивает экспрессию генов, продукты которых необходимы для S-фазы клеточного цикла. Кроме того, Е7 взаимодействует с циклинами, циклинзависимыми киназами и другими белками, регулирующими клеточный цикл. Еще одним фактором, способствующим пролиферации клеток, является белок Е5. Он синтезируется вслед за Е6 и Е7, усиливая экпрессию рецепторов для ростстимулирующих цитокинов. Это повышает чувствительность к митогенным и дифференцировочным стимулам, которые эпителиоциты получают из окружающей среды.
Обобщая, можно сказать, что благодаря взаимодействию е6-, е7- и е5-генов клетки обретают пермиссивность, т.е. способность поддерживать репродукцию HPV. В репликации HPV-ДНК участвуют белки Е1 и Е2. Е2 обеспечивает связывание инициаторного LCR-сайта с Е1, а тот в свою очередь подключает комплекс клеточных белков, необходимых для репликации ДНК. Е2 выступает и в роли регулятора транскрипции вирусных генов, определяя место сборки и действия РНК-полимеразы.
Важной функцией белка Е2 является подавление транскрипции е6- и е7-генов, т.е. синтеза белков Е6 и Е7. Это восстанавливает антипролиферативную активность р53 и рRB, содействуя дифференцировочному процессу эпителиоцитов и синтезу поздних HPV-белков, L1 и L2. Фактор, инициирующий транскрипцию l1- и l2-генов, не известен, но он, безусловно, связан с дифференцировкой эпителиальных клеток, так как образование L1 и L2 начинается по достижении ими определенной степени зрелости (в эпидермисе — клетки верхнего шиповидного и зернистого слоев (см. рисунок).
Белки L1 и L2 транспортируются в ядро, где происходит сборка вирусных частиц. Вирионы высвобождаются пассивно (без цитолиза) при дезинтеграции поверхностных клеток, возможно, при участии белка Е4. Слущиваемые клетки (в том числе роговые чешуйки эпидермиса) контагиозны.
Малигнизация. Взаимоотношения с HPV могут выходить за рамки доброкачественного конфликта, завершаясь злокачественной трансформацией эпителиальных клеток. Классический пример — рак шейки матки (цервикальная карцинома), хотя известны и другие раковые опухоли, чаще урогенитальной сферы, ассоциированные с папилломавирусами. Из 30 HPV-типов, которые распространяются половым путем и первично инфицируют урогенитальные органы, при цервикальном раке чаще всего встречаются типы 16, 18, 31 и 45. Около половины случаев ассоциированы с HPV-16, 25—30% — с HPV-18, 31 и 45. В целом группу высокого риска составляют более десятка HPV-типов. С ними ассоциировано почти 100% случаев плоскоклеточного рака шейки матки. Для цервикальных аденокарцином корреляция не столь значительна и существенно зависит от возраста. У женщин моложе 40 лет HPV присутствуют в 89% аденокарцином, у женщин 60 лет и старше — в 43%.
Основой неопластической трансформации клеток служит HPV-персистенция. Репликации вируса не происходит, и о его присутствии судят по наличию вирусных генов в базальном эпителии. Во многих случаях это не ведет к видимым патологическим изменениям. По разным данным, бессимптомная HPV-инфекция цервикального канала наблюдается у 10—40% женщин. Нередко повторное обследование через несколько месяцев дает отрицательный результат, отражая транзиторный характер носительства. Но латенция может быть и упорной, предрасполагая к осложнениям, главным из которых является канцерогенное (злокачественное) перерождение эпителия. У 15—30% женщин, позитивных по HPV, в течение двух лет развиваются предраковые изменения шейки матки; при отсутствии HPV-ДНК тот же показатель составляет 1—3%. Корреляция характерна для HPV-типов высокого риска, прежде всего 16 и 18. HPV-ДНК может присутствовать и в нормальных эпителиоцитах, прилегающих к папилломам. Это предрасполагает к рецидивам после удаления видимого очага опухоли.