Содержание
Главная роль в этиологии острого гастроэнтерита принадлежит вирусам. Утверждение этой позиции началось в 1940-х гг., но окончательно состоялось лишь в начале 1970-х гг., когда в фекалиях детей с гастроэнтеритом были обнаружены вирусы Норуолк (Norwalk) и ротавирусы и доказано их отношение к данному заболеванию. В настоящее время известно четыре семейства вирусов, которые способны вызывать острый гастроэнтерит у человека — ротавирусы (Reoviridae), калицивирусы, включая Норуолк (Caliciviridae), аденовирусы (Adenoviridae, типы 31, 40, 41 — см. «Аденовирусы») и астровирусы (Astroviridae). Подозревается значение и других вирусов (например, торовирусов, коронавирусов, энтеровируса 22 и др.). Их роль в происхождении гастроэнтерита не доказана, хотя вполне вероятно, что будут открыты новые вирусные агенты, принимающие участие в интестинальной патологии, — этиология 40—50% диарей остается нераскрытой. Основными возбудителями острого гастроэнтерита являются ротавирусы.
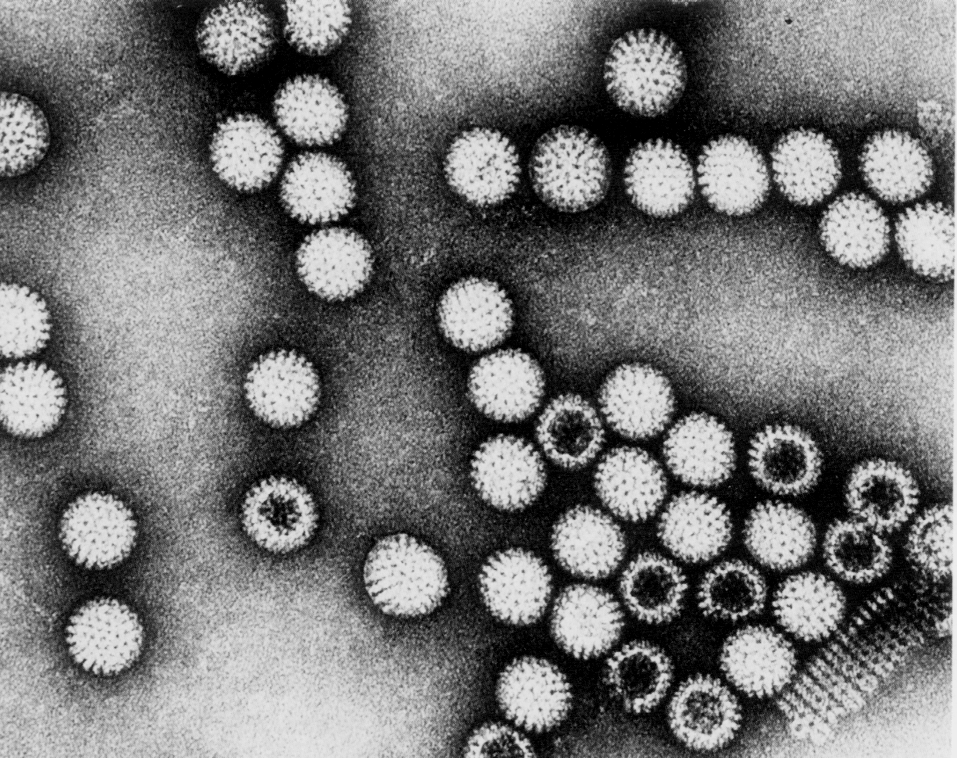
Ротавирусы получили свое название из-за того, что под электронным микроскопом напоминают колесо с короткими спицами и хорошо развитым ободом (лат. rota — колесо; рис. 1).
Позже оказалось, что по своему строению и жизненному циклу ротавирусы похожи на реовирусы. В 1978 г. они были выделены в специальный род, Rotavirus, семейства Reoviridae. Это семейство включает девять родов. Четыре из них (Orthoreovirus, Rotavirus, Coltivirus, Orbivirus) способны инфицировать человека, но заболевания вызывают почти исключительно ротавирусы. Представители четырех других родов инфицируют растения и насекомых; один род связан с поражением рыб.
У термина «реовирусы» интересная этимология. Реовирусы были обнаружены в респираторном и кишечном трактах человека и животных, но их значение оставалось неизвестным. Поэтому они были названы реовирусами от слов «респираторный», «энтеральный» и «orphan» (англ. orphan, сирота), т.е. вирусы с неустановленной ролью в патологии.
Вирион и репродукция ротавирусов
Вирион ротавирусов имеет диаметр 70—75 нм и состоит из трех структурных элементов — сердцевины (кора), наружного и внутреннего капсидов с икосаэдрической симметрией. Капсомеры внутреннего капсида выглядят как радиальные спицы, образуя подобие колеса, где наружный капсид служит ободом. Кор содержит геномную РНК и внутренние белки — VP2 (главный структурный компонент внутренней мембраны), VP1 и VP3 (белки, отвечающие за РНК-зависимую РНК-полимеразную активность и кэппинг вирусной мРНК). Как и у других реовирусов, геном ротавирусов представлен 11 сегментами минуснегативной двунитчатой РНК с общей массой более 18000 пар оснований. Каждый из сегментов кодирует единственный вирусный белок, т.е. является моноцистронной матрицей. Исключением служит сегмент VP7 — бицистронный ген, в котором записано два гликопротеина с двух инициирующих кодонов в одной рамке считывания.
Внутренний и наружный капсиды содержат три белка — VP6, VP7 и VP4. Это главные антигены, которые используются в классификации ротавирусов и служат началом для взаимодействия вириона с клетками-мишенями. VP4 и VP7 называются нейтрализующими антигенами, так как анти-VP4- и анти-VP7-антитела блокируют вирусную инфекцию in vitro. При обработке трипсином VP4 расщепляется на два пептида, VP5* и VP8*, что ведет к активации инфекционных свойств вириона и возможности культивирования ротавирусов in vitro.
Рецепция вириона происходит достаточно сложно. Сначала в реакцию включается VP8 (продукт трипсинного расщепления VP4), который связывается с сиаловой кислотой или ганглиозидом GM1a инфицируемой клетки. Далее происходит взаимодействие VP4 и VP7 с a2b1— и a4b1-интегринами. Затем в реакцию включаются другие клеточные гликопротеины, гликолипиды и холестерол, которые формируют зону восприятия вируса. Вирион проникает путем эндоцитоза, используя VP4 (VP5) и VP7 для пробуравливания плазматической мембраны клетки.
Процесс раздевания вируса продолжается внутри клетки. Низкая концентрация Са2+ в рецептосоме ведет к дезинтеграции наружного капсида, обеспечивая выход в цитоплазму однокапсидной вирусной частицы. В ее составе происходит активация РНК-зависимой РНК-полимеразы и синтез плюс-нитей РНК, которые кэпируются и выделяются через многочисленные поры однокапсидного вириона. Готовые плюс-РНК (мРНК) идут на образование структурных и неструктурных вирусных белков. Неструктурные белки (NSP1—NSP6) участвуют в самосборке однокапсидной субвирусной частицы, синтезе минус-нитей РНК, ее почковании через гранулярную эндоплазматическую сеть и, наконец, освобождении полных двухкапсидных вирионов в результате клеточного лизиса. Частица временно обретает псевдооболочку, которая быстро замещается белками наружного капсида, т.е. VP4 и VP7. Весь процесс занимает 6 ч, достигая максимума через 15—24 ч.
VP6 представляет собой белок внутреннего капсида, связывая в единое целое коровый белок VP2 и белки наружного капсида, VP4 и VP7. Он несет групповые эпитопы (A—G), хотя все ротавирусы связаны антигенным родством. В медицинской микробиологии наибольшее значение имеет группа А, которая отвечает почти за 100% детского ротавирусного гастроэнтерита. Ротавирусы В известны как зоонозные возбудители диарей у взрослых и детей (источник инфекции — крысы), эндемичны для Китая. Были сообщения о вспышках ротавирусной инфекции группы С. Возможно, заражение произошло от свиней, которые выделяют эти ротавирусы.
Вирусы группы А делятся на подгруппы и множество серотипов. По особенностям VP6 выделяют по меньшей мере четыре подгруппы, из которых для человека важны подгруппы I и II. Но большее значение имеет деление на серотипы, дающее возможность судить об основных протективных антигенах вируса, задействованных в патологии. Это важно для суждения об эпидемиологии заболеваний и подбора иммунологических препаратов с целью их профилактики и лечения. Сегодня известно 14 VP7-серотипов (G-серотипы, от англ. glycoprotein) и 20 VP4-типов (Р-типы, от англ. protease-sensitive protein). Не все Р-типы подтверждены как серотипы, поэтому применяют два понятия — Р-серотипы и Р-генотипы. Между ними имеется ряд важных, но не абсолютных совпадений. Например, наиболее распространенные Р-серотипы 1А и 1В соответствуют генотипам 8 и 4, в то время как генотипы 2 и 3 могут попеременно встречаться с серотипом 5В. Поэтому предложена двойная система классификации ротавирусов по VP4, которая учитывает серотип и генотип VP4. При ее использовании G-Р-серотип дополняется в скобках Р-генотипом, например, G1Р1А [8]. Часто ограничиваются обозначением Р-генотипа, G1P8. Человека инфицирует ограниченное число G-P-вариантов. Доминирующими являются G1-4-серотипы и Р4-, Р6-, Р8-генотипы (их различают по полимеразной цепной реакции).
Так как VP7 и VP4 кодируются разными РНК-сегментами, они могут независимо перемещаться, давая множество G-P-комбинаций в процессе пересортировки генов in vitro и in vivo.
К примеру, G3 может нести детерминанты по крайней мере пяти Р-типов (Р2, Р3, Р8, Р12, Р16), а Р8-тип — четырех различных G-серотипов (G1, G3, G4, G9). Некоторые G-P-типы определяются только у человека (например, G9, G12, P4, P6, P8) или у животных (G11, G13, P3, P11). Известны комбинации, которые наблюдались как у людей, так и у животных, что допускает вероятность зоонозной трансмиссии.
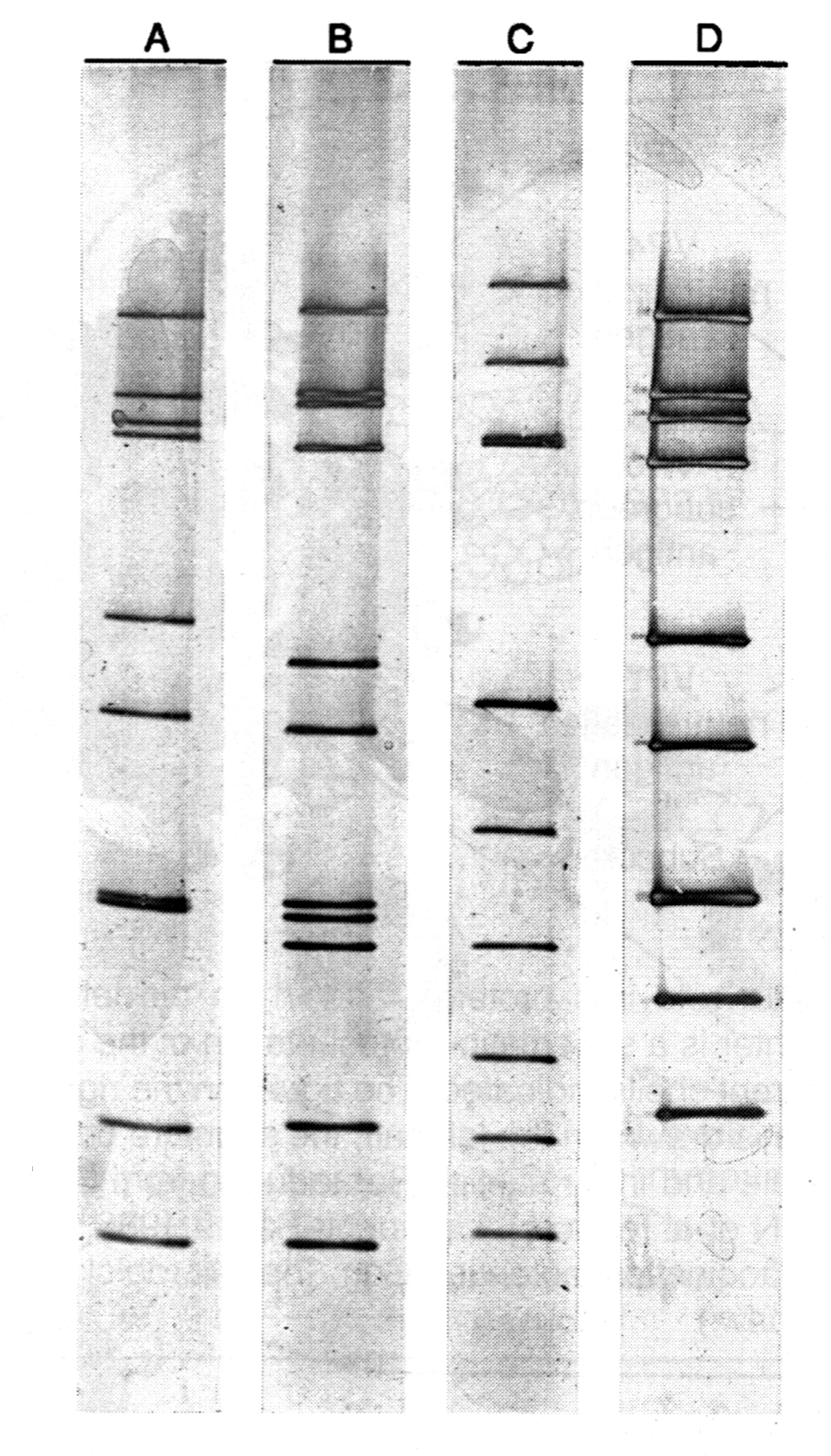
Для дифференцировки различных изолятов предложено использовать электрофоретический профиль геномных РНК-сегментов в полиакриламидном геле — так называемый электроферотип (напомним, что геном ротавирусов представлен 11 сегментами РНК). В многочисленных исследованиях продемонстрирована высокая геномная гетерогенность ретровирусов, которая оказалась стабильным признаком штамма, полезным для эпидемиологического анализа. Кроме длинных и коротких электроферотипов (по сравнительной скорости миграции РНК-сегментов 10 и 11) наблюдаются особенности передвижения отдельных компонентов (рис. 2). Детали электроферотипов не совпадают с серотипами, оставляя за последними приоритет в разработке методов контроля над инфекцией.