Содержание
Образование вирионных (структурных) белков закодировано в трех генах. Продукт каждого из них представляет собой полипротеин-предшественник, который после расщепления (протеолиза) превращается в зрелые белки. Белки сердцевины и матриксный белок синтезируются в виде предшественника, закодированного в gag-гене (англ. group antigen). Вирионные ферменты возникают на основе продукта pol-гена (англ. polymerase). Суперкапсидные белки образуются при расщеплении сильно гликозилированного протеина на основе env-гена (англ. evelope). Протеолиз протекает в несколько этапов под действием вирусной и клеточных протеаз (см. ниже).
Генетический анализ ВИЧ-изолятов, полученных в различных регионах земного шара, утвердил представления о неоднородности ВИЧ. По особенностям нуклеотидного профиля env- и gag-генов предложено дифференцировать субтипы, или клады (греч. klados — ветвь) ВИЧ-1, которые объединены в три основные группы: М, N и О. Подавляющее большинство случаев ВИЧ-1 инфекции связано с вирусами М-группы (англ. major — главный). Им противопоставлена О-группа (англ. outliner — в стороне), которая включает небольшое число вариантов преимущественно из Западной Африки. N означает штаммы ВИЧ-1, не относящиеся к группам М и О.
М-группа содержит субтипы — от А до I. В странах Америки, Западной Европы, в Австралии и Японии преобладает субтип В (около 50%); вслед за ними идут субтипы А (16%), С, D и Е (по 10% каждого). Другие субтипы встречаются гораздо реже. В Африке доминируют субтипы А и С, в странах Юго-Восточной Азии чаще встречается субтип Е. Эпидемия в Индии вызвана субтипом С.
Первый случай СПИДа на территории Российской Федерации был вызван вирусом субтипа А. В период 1987—1990 гг. в России выделялись вирусы субтипов В, G и C. В настоящее время в России доминирует субтип А, распространяющийся среди наркоманов (более 75% случаев).
Доказана возможность сочетанного заражения разными кладами с возникновением мозаичных (рекомбинантных) вариантов ВИЧ-1. Они составляют около 10% всех ВИЧ-геномов с известной нуклеотидной последовательностью. В настоящее время известны все возможные сочетания, по крайней мере, для субтипов А—D, F—H.
Развитие ВИЧ-инфекции — многофазный и многофакторный процесс, в основе которого лежит прогрессирующее поражение иммунокомпетентных клеток. Главной мишенью для вируса служит хелперная субпопуляция Т-лимфоцитов. Это объясняется тем, что Т-хелперы несут на своей поверхности рецептор CD4, который связывается с одним из поверхностных ВИЧ-белков — gp120. CD4 Т-лимфоциты обеспечивают более 90% репликативного выхода вируса.
Вторыми по значимости являются мононуклеарные фагоциты: около 40% моноцитов крови и тканевых макрофагов содержат CD4. Известны и другие категории CD4-позитивных клеток (дендритные клетки, естественные киллеры, нейроны), но этот признак выражен у них гораздо слабее и менее постоянно.
Есть клетки, которые не имеют CD4 рецепторов, но тем не менее чувствительны к ВИЧ. К ним относятся М-клетки слизистой прямой кишки и сперматозоиды. Это означает, что по крайней мере часть вирусных клонов воспринимается независимо от CD4 за счет дополнительных клеточных структур. Установлено, что ВИЧ взаимодействует с маннозосвязывающим белком макрофагов и дендритных клеток, галактозилцерамидом нейроглии, рецепторами, сопряженными с G-белками. Они реагируют все с тем же gp120, но сайты связывания не совпадают между собой и с лигандом для CD4. Известны и примеры наведенной (опосредованной) ВИЧ-рецепции за счет связывания вирионов, покрытых антителами и С3-фактором комплемента.
Чтобы попасть в клетку, вирусу необходим второй суперкапсидный белок (gp41): он обеспечивает слияние клеточной и вирусной мембран благодаря связыванию с F-пептидом клеток (от англ. fusion — слияние). Синтезирован пептид, который после связывания с gp41 препятствует репликации вируса в чувствительных клетках. Это делает его одним из кандидатов для включения в комплексную анти-ВИЧ-терапию.
Но главными кофакторами ВИЧ-заражения служат два хемокиновых рецептора, СХСR4 и CCR5. Вместе с CD4 они взаимодействуют с gp120, раскрывая функцию слияния gp41. Хемокины, т.е. естественные лиганды для CXCR4 и CCR5, блокируют этот процесс, задерживая размножение ВИЧ в лимфоцитах. Врожденный дефицит по CXCR4 и CCR5 (не опасный для его обладателей) рассматривается как фактор, предохраняющий от ВИЧ-инфекции.
Небезразличным считается и присутствие в ВИЧ-оболочке белков клетки-хозяина. Некоторые из них (например, HLA-2, CD54, CD11a), возможно, вносят вклад в особенности реакций на внедрение вируса — от активации до апоптоза клеток.
Жизненный цикл
Репликация ВИЧ (рис. 3) не отличается от других ретровирусов, но находится под более сложным контролем, который включает факторы позитивной и негативной регуляции. Их активность определяет соотношение между латенцией вируса и продуктивной (гибельной для клетки) инфекцией.
Вирус проникает в клетку путем рецепторзависимого эндоцитоза. После слияния плазматической и суперкапсидной мембран сердцевина вириона оказывается в цитоплазме. Далее с помощью обратной транскриптазы производится синтез комплементарной ДНК. Вирусная РНК-аза разрушает использованную РНК-матрицу, а обратная транскриптаза, действуя как обычная ДНК-полимераза, достраивает вторую ДНК-нить. Это происходит быстро: уже через 2 ч после инфицирования в цитоплазме и ядре обнаруживаются вирусные ДНК.
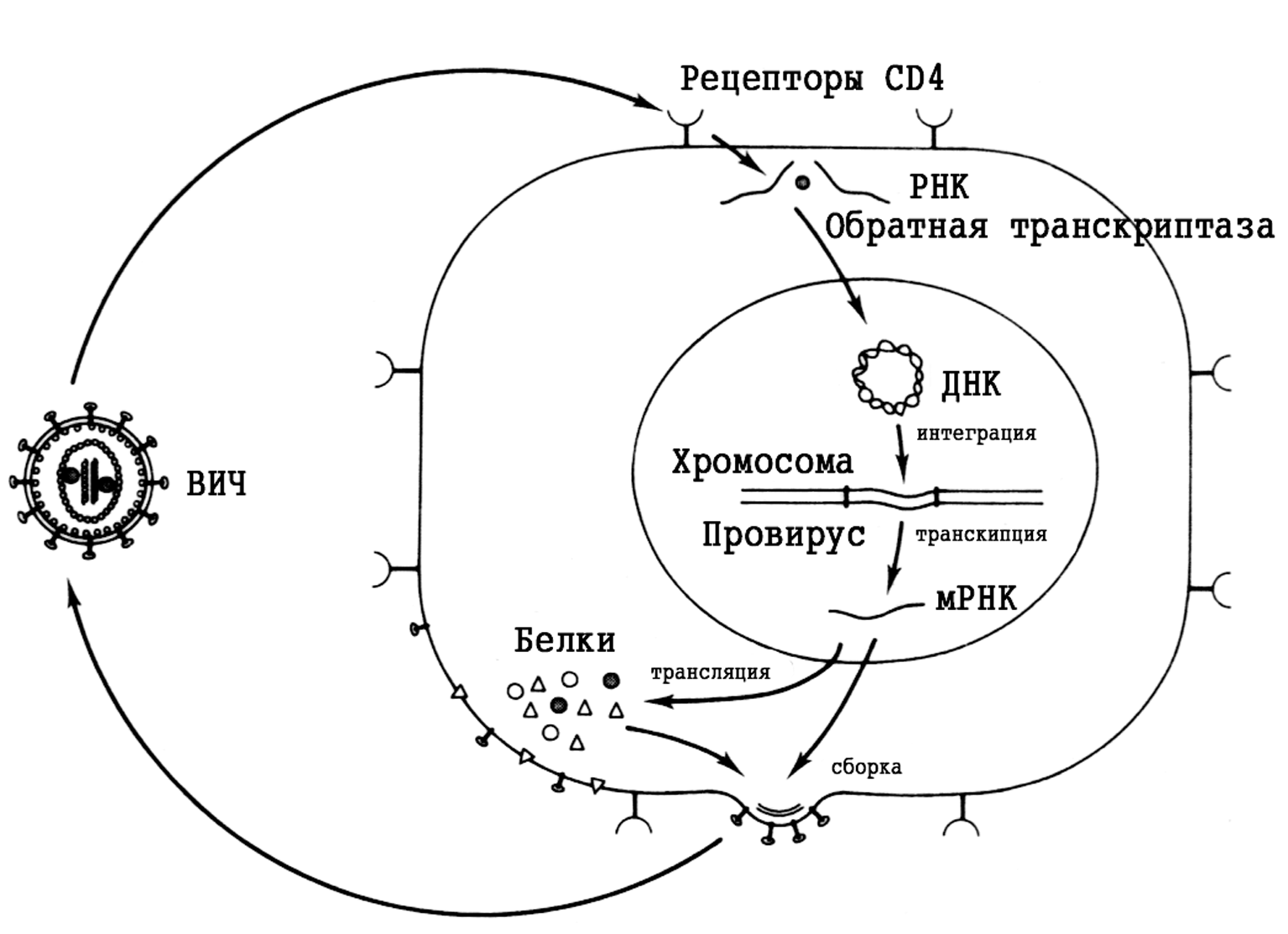
Синтез ДНК сопровождается важным для вируса событием: концевые участки геномной РНК копируются дважды, образуя так называемые длинные концевые повторы, LTR (от англ. long terminal repeat) — около 630 пар нуклеотидов на каждом из концов ДНК. Они необходимы для включения вирусной ДНК в состав хромосом и для дальнейшей регуляции вирусных генов.
Готовая ДНК (она временно обретает замкнутую кольцевидную форму, предохраняющую от разрушения клеточными нуклеазами) перемещается в ядро, где включается в хромосомы. Этот процесс, называемый интеграцией, реализуется вирионным ферментом — интегразой. Действуя как эндонуклеаза, она разрезает в определенных местах клеточную ДНК, соединяя рассеченные концы с LTR вируса. С этого момента генетический материал ВИЧ называется провирусом. Он ведет себя как обычный клеточный ген, переходя при делении в дочерние клетки и воспринимая сигналы, контролирующие транскрипцию.
Перед вирусом стоит альтернатива. Он может надолго выйти из игры, ничем о себе не заявляя, либо перейти в продуктивную фазу, занявшись воспроизведением собственного потомства. В этом случае вирусная ДНК транскрибируется клеточной РНК-полимеразой, направляемой сигналами с LTR. Часть синтезированных РНК-молекул используется как мРНК, другие (полные по длине транскрипты) служат репликативными РНК для новых вирусных частиц. Сборка вирионов завершается формированием наружной оболочки. Это происходит при почковании через участки плазматической мембраны с встроенными суперкапсидными белками (cм. рис. 1).
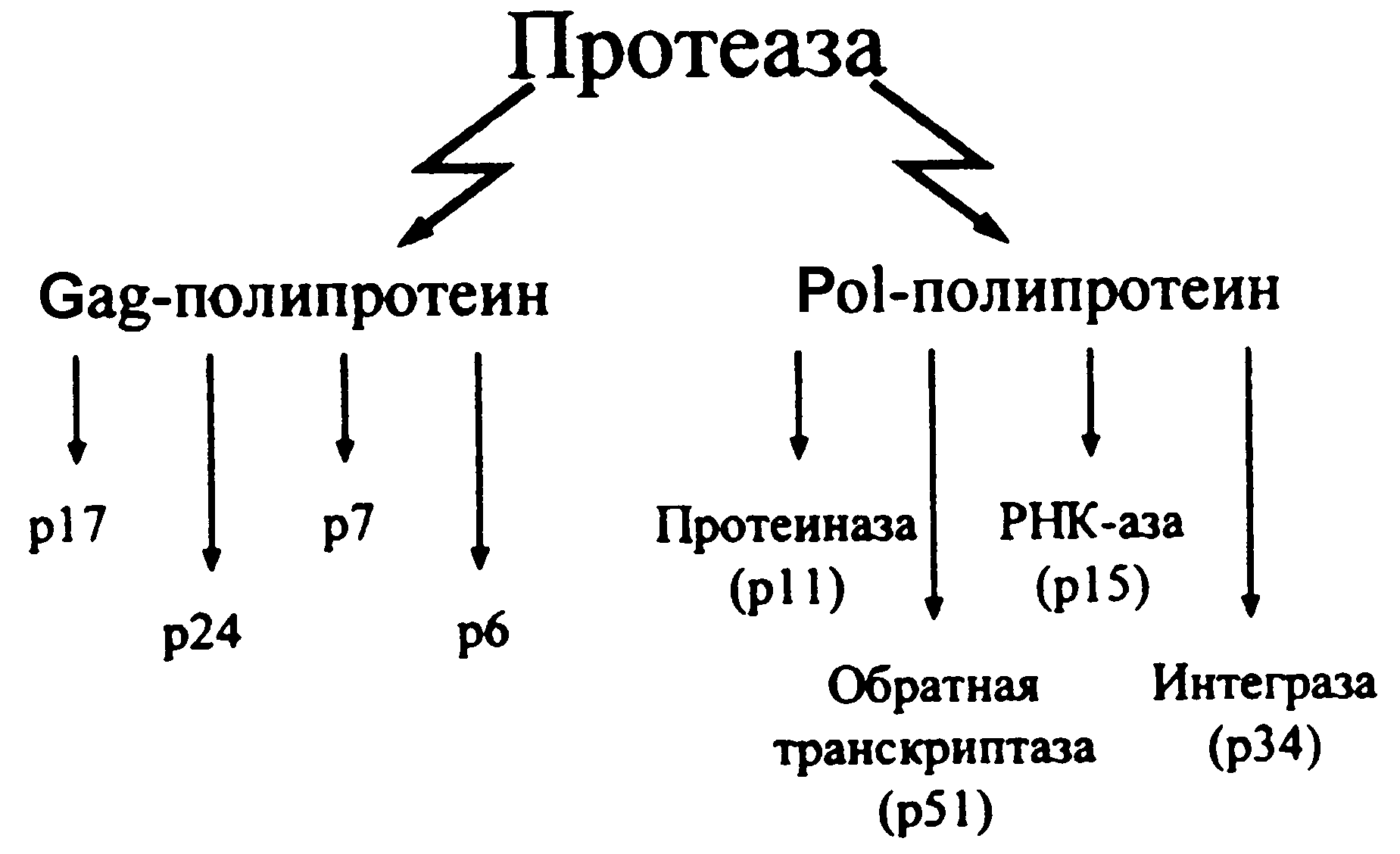
В ходе репликативного процесса ВИЧ синтезирует три полипротеина (Gag, Pol и Env), которые служат основой для получения структурных белков. Вирионная протеаза (она аутокаталитически вычленяется из Pol-полипротеина) доводит до кондиции белки-предшественники сердцевины (Gag) и ферментного комплекса (Pol) (рис. 4). Образование суперкапсидных белков (gp120 и gp41) обеспечивается из Evp-предшественника клеточной протеазой.
Чтобы поддерживать репродукцию вируса, клетка должна быть метаболически активной. У лимфоцитов этому соответствует фаза пролиферации, возбуждаемая антигенами или цитокинами. Это непрерывный и неизбежный процесс, который периодически усиливается или ослабевает. На уровне организма ВИЧ-инфекция никогда не достигает полной латенции, и признаки активной репликации в виде более или менее выраженной вирусемии всегда налицо. Это поддерживает непрерывный и исключительно интенсивный кругооборот вирионов: обновление циркулирующего ВИЧ-пула происходит каждые два часа.