Содержание
Число циркулирующих CD4 Т-клеток снижается уже на этапе первичной ВИЧ-вирусемии. Цитотоксические Т-лимфоциты и антитела приостанавливают этот процесс, но полного восстановления не происходит. После относительной компенсации (она продолжается несколько месяцев) количество Т-хелперов неуклонно сокращается и в терминальной фазе падает почти до нуля (100 клеток/мкл и ниже; в норме более 1000 клеток/мкл). Коэфициент СD4/CD8 в крови спускается ниже 1,0 (в норме 2,0 и выше).
Казалось бы, все очевидно: гибнут клетки, в которых размножается вирус. Но эта логика для ВИЧ слишком проста. На любом из этапов ВИЧ-инфекции заражается не более 5% Т-хелперов и поэтому даже при высокой скорости кругооборота вируса и реинфицирования новых мишеней таким путем уничтожается сравнительно небольшое количество клеток. Деструктивные ресурсы ВИЧ реализуются через дополнительные каналы. Прокомментируем некоторые из них.
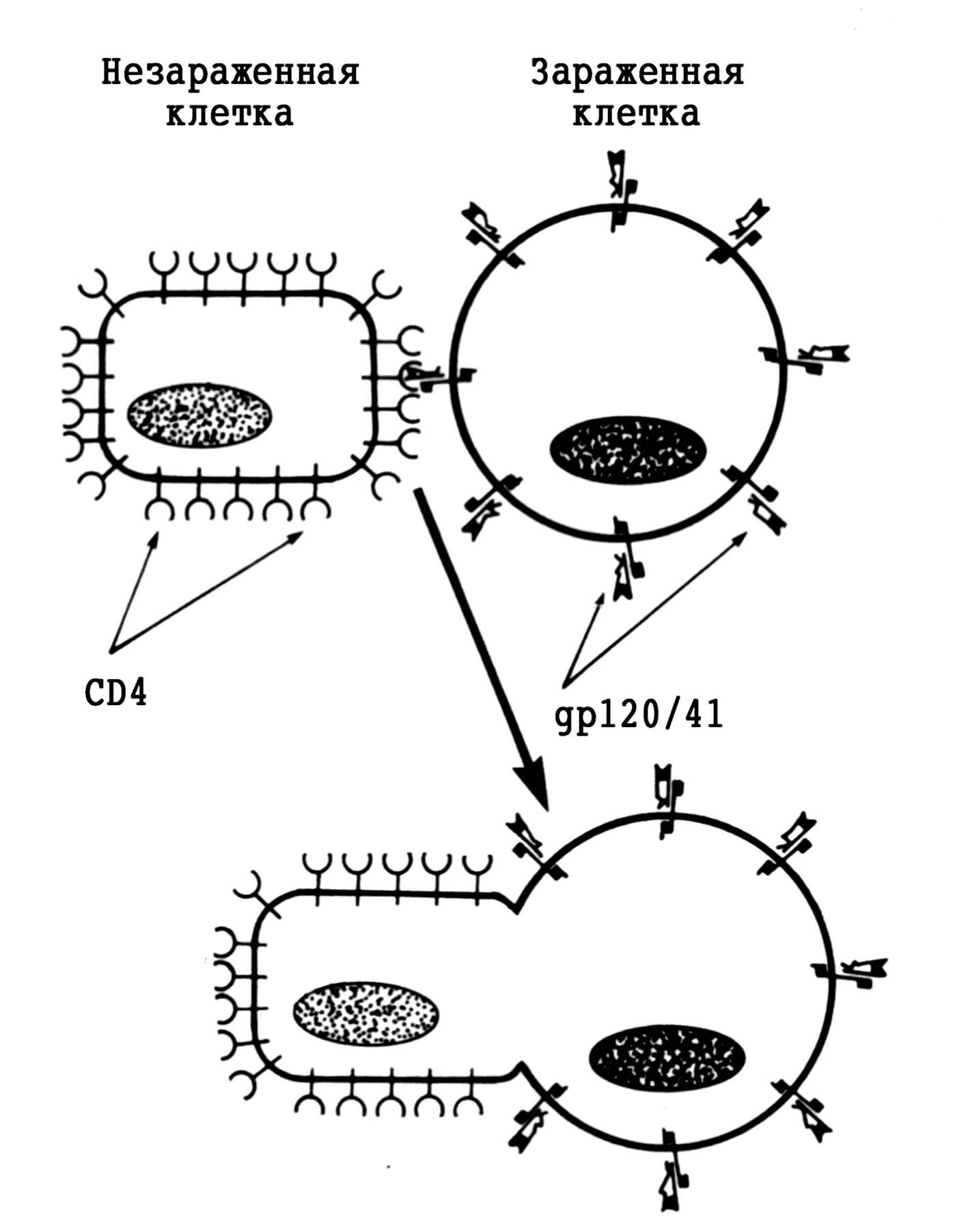
Подобно другим оболочечным вирусам, ВИЧ индуцирует слияние клеток с образованием нежизнеспособных поликарионов. Это происходит в том случае, если вирусные белки (gp120), встроенные в плазматическую мембрану инфицированного Т-лимфоцита, связываются с рецепторами (CD4) соседних клеток (рис. 5). Единственная зараженная клетка способна втянуть в реакцию до 50 свободных от вируса соседей, что существенно расширяет масштаб повреждения. Мутационное замещение всего нескольких аминокислот в СD4-связывающем домене gp120 лишают вирус этого признака.
При репликации многие gp120 не включаются в вирионы, а сбрасываются в окружающую среду. Связываясь с CD4-рецепторами соседних клеток, свободный gp120 превращает их в потенциальную мишень для анти-ВИЧ-антител. Это предрасполагает к комплементзависимому цитолизу или к повреждению агрессивными клетками, несущими рецепторы для Fc-фрагмента IgG (макрофаги, нейтрофилы, естественные киллеры). Действительно, у больных СПИДом имеются признаки активации комплемента, но это вовсе не означает ее избирательной направленности против зараженных вирусом клеток: динамика ВИЧ-антител не совпадает с сокращением Т-хелперной субпопуляции. Что касается антителозависимой клеточной цитотоксичности, то для ее реализации необходимо столько условий, что многие сомневаются в действенности данного механизма in vivo.
Обсуждается вопрос о ВИЧ-индуцированном апоптозе Т-лимфоцитов. Полагают, что таким способом могут погибать незараженные CD4 клетки, попадающие в сферу влияния ВИЧ-продуктов. Среди факторов, возбуждающих апоптоз, называются сшивка CD4-gp120, блокада клеточного цикла регуляторными ВИЧ-пептидами, сигналы в системе Fas(CD95)—FasL. В инвитровых культурах Т-клетки, обработанные ВИЧ или его продуктами, неадекватно реагируют на антигены и цитокины, подвергаясь апоптозу.
Гистологический анализ обнаруживает глубокое извращение цитоархитектоники лимфатических узлов больных СПИДом, прежде всего за счет разрушения сети дендритных клеток, необходимых для стабилизации межклеточных контактов и представления антигенов Т-лимфоцитам. Не исключено, что это одно из последствий Т-хелперного дефицита, хотя среди изобилия ВИЧ-мутантов встречаются клоны, способные реплицироваться в дендритных клетках и вызывать их повреждение. Это содействует гибели Т-лимфоцитов, выступая в роли кофакторов иммунодефицита. Не следует забывать и о том, что ВИЧ заражает плюрипотентные стволовые клетки костного мозга, тимоциты и стромальные клетки тимуса. Это предрасполагает к ослаблению гемопоэза и тимопоэза, углубляя дефицит иммунокомпетентных клеток и панцитопению, характерную для терминальной фазы заболевания.
Уже в первых публикациях высказывалось мнение о том, что иммунная система при ВИЧ-инфекции исходно страдает не столько из-за дефицита иммунокомпетентных клеток, сколько от нарушения межклеточных контактов. Эта парадоксальная позиция имеет тем не менее серьезные основания. К примеру, на инфицированных лимфоцитах снижается число CD4-рецепторов, необходимых для HLA-зависимых контактов с антигенпредставляющими клетками. Кроме регуляторных ВИЧ-пептидов этому способствует экранирование CD4 свободным белком gp120, который отщепляется от зараженных клеток. Межклеточная кооперация ослабевает и из-за сокращения молекул HLA-2 на поверхности макрофагов и дендритных клеток, что отрицательно сказывается на представлении антигенов Т-хелперам. Вырисовывается и вероятность функциональной блокады CD8 Т-лимфоцитов. Есть данные о том, что этот дефект возникает в начале инфекции, прогрессируя вместе со снижением числа циркулирующих CD4 Т-лимфоцитов и клиникой заболевания.
Много внимания уделяется перекосам в системе цитокинов. В опытах с моноцитами и Т-клетками некоторые из цитокинов (ИЛ-1b, ИЛ-6, гранулоцитарно-макрофагальный колониестимулирующий фактор, a-фактор некроза опухолей) усиливают ВИЧ-репликацию. Их главным источником служат CD4 Т-лимфоциты и макрофаги, которые активируются на фоне ВИЧ- индуцированного цитокинового дисбаланса.
Теперь, пожалуй, следует рассказать о самом щекотливом парадоксе ВИЧ-иммунодефицита. Классическая трактовка СПИДа как финала опережающего обвала Т-хелперов не объясняет дихотомии (расщепления) иммунодефицитного синдрома, а именно избирательного поражения клеточного иммунитета при относительном благополучии гуморального звена. Это трудно понять, если учесть, что индукция гуморального ответа тоже зависит от CD4 Т-клеток и должна была бы страдать не меньше, чем клеточный иммунитет. Выйти из этого противоречия можно, лишь признав неоднородность Т-хелперов с их разделением на варианты, неодинаковые по чувствительности к ВИЧ и по активности в реакциях клеточного и гуморального иммунитета. Подобная мысль была высказана вскоре после обнаружения первых случаев СПИДа. В иммунных реакциях задействовано более 40 цитокинов, часть из которых выделяется CD4 Т-хелперами. Некоторые из них (цитокины 1-го типа) усиливают реакции клеточного иммунитета, другие (цитокины 2-го типа) — образование антител. Т-хелперы, индуцирующие клеточный иммунитет, получили акроним Th1 (от англ. helper); продуценты В-цитокинов называются Th2. Все Th-варианты возникают из Th-предшественников (Th0) под влиянием дифференцировочных цитокинов, исходящих главным образом из самих иммунокомпетентных клеток.
Признание поляризации хелперных Т-лимфоцитов (то же самое справедливо и для CD8 Т-клеток) — одно из крупных откровений последних лет, которое оказало существенное влияние на представления о патогенезе инфекционных и иммунопатологических процессов. Баланс Th1-Th2 динамичен, сдвигаясь в ту или иную сторону при различных нарушениях гомеостаза, в том числе инфекционной природы. Выходя за определенные рамки, дихотомия Т-хелперов может извратить эффекторные функции иммунитета, направляя их в русло патологии. Отсюда не случайно, что ВИЧ-инфекция с характерной для нее поляризацией иммунодефицита оказалась в центре дискуссий относительно патогенетической значимости Th1-Th2 перестроек.
Есть мнение, что ВИЧ индуцирует перекос в пользу Th2-зависимых реакций, одновременно подавляя Th1-зависимую наработку цитотоксических (анти-ВИЧ) Т-лимфоцитов. Это снижает контроль над вирусом, создавая предпосылки для развития СПИДа. Более того, опираясь на медиаторный дисбаланс, некоторые из цитокинов типа 2 способны усиливать репликацию ВИЧ. Преобладание Th2-функций рассматривается как одна из причин лимфаденопатии и гипергаммаглобулинемии — типичных спутников предспидового периода ВИЧ-инфекции (см. ниже). И то и другое может быть результатом избыточной стимуляции В-лимфоцитов в разбалансированной системе цитокинов.
Вместе с тем анализ Th1-Th2 перекосов не дал однозначных результатов. Нет уверенности и в их патогенетическом лидерстве. Не исключено, что это следствие истощения лимфоидной ткани, а не пусковой фактор грядущего иммунодефицита. Однако в любом случае раскрытие причин, сдвигающих равновесие между субпопуляциями CD4 Т-лимфоцитов, намечает перспективы по сдерживанию ВИЧ-патологии на основе исправления цитокиновых перекосов.
Патология
В клинических классификациях детально анализируются стадии и подстадии ВИЧ-инфекции. Богатая клиническая симптоматика вначале отражает конфликт между полноценной иммунной системой и вирусом (острая ВИЧ-инфекция), затем — длительную фазу относительной компенсации (хроническая ВИЧ-инфекция) и, наконец, глубокий иммунодефицит (СПИД). Подготовка к СПИДу занимает около 10 лет, но может быть короче или длиннее. Изредка встречаются случаи с устойчивым уровнем CD4 Т-лимфоцитов, низкой репликативной активностью вируса и полной клинической латенцией. Они остаются интригующей загадкой, составляя менее 5% от общего числа ВИЧ-инфицированных.