Содержание
Противопоказания к операции общие — тяжелая сопутствующая патология, не поддающаяся консервативному лечению.
C начала развития хирургии ахалазии пищевода предложено и предлагается большое количество самых разнообразных оперативных вмешательств. Ряд из них (операции на нервной системе; операции на диафрагме — хиатотомия, диафрагмокруротомия; обходные операции; вмешательства с резекцией пищевода и пищеводно-желудочного перехода с реконструкцией и без реконструкции кардии; операции, направленные на расширение узкого сегмента пищевода и т.д.) представляют лишь исторический интерес.
Из всех операций в России и за рубежом получила распространение внеслизистая эзофагокардиомиотомия по Геллеру, предложенная в 1913 г. (рис. 6), и ее различные модификации.
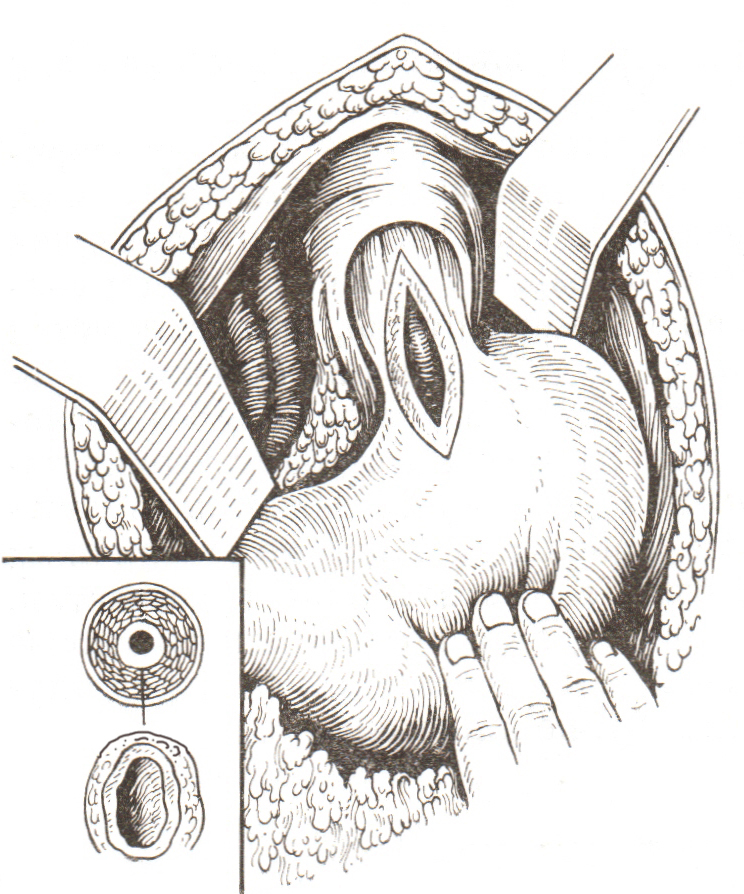
Heller впервые выполнил внеслизистое продольное рассечение мышц в суженном участке кардии. При этом кардия расширяется, а пролабирующая слизистая прикрывается подшиванием лоскута свободного сальника.
По данным зарубежных авторов, эта операция является приоритетной среди всех видов оперативного лечения. H. Viard (1987), F. Johnsson et al. (1987) отмечают отличные и хорошие результаты эзофагомиотомии по Геллеру в 65–94% случаев.
Однако в настоящее время операция Геллера в так называемом чистом варианте не используется из-за возникновения таких осложнений, как недостаточность кардии, рецидив болезни (36–50% случаев), дивертикулов пищевода и грыж пищеводного отверстия диафрагмы.
Сейчас данная методика применяется в различных модификациях, которые отличаются способом укрытия дефекта, образующегося после миотомии, т.е. способами кардиопластики. Целесообразность сочетания миотомии и кардиопластики обоснована развитием меньшего числа осложнений.
Для профилактики осложнений кардиопластические операции должны соответствовать следующим требованиям:
- адекватная эзофагокардиомиотомия (длина разреза);
- разведение рассеченных эзофагокардиальных мышц и удержание их в состоянии достаточного диастаза (не менее 1/2 окружности пищевода);
- пластическое замещение серозно-мышечного дефекта (однородные ткани, не вызывающие вторичного сморщивания кардии);
- адекватное восстановление жомно-клапанной функции кардии.
Выполнение всех вышеперечисленных требований обеспечивает yспех лечения.
Наибольшее распространение в 60–80-е годы прошлого столетия получила кардиопластика диафрагмальным лоскутом, предложенная Б.В. Петровским в 1957 г. Дефект в стенке пищевода после миотомии прикрывался лоскутом соответствующего размера, выкроенным из диафрагмы (рис. 7).
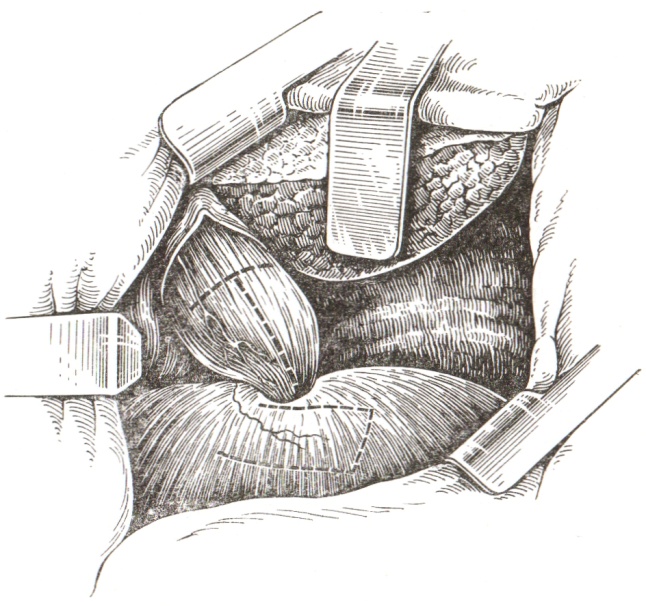

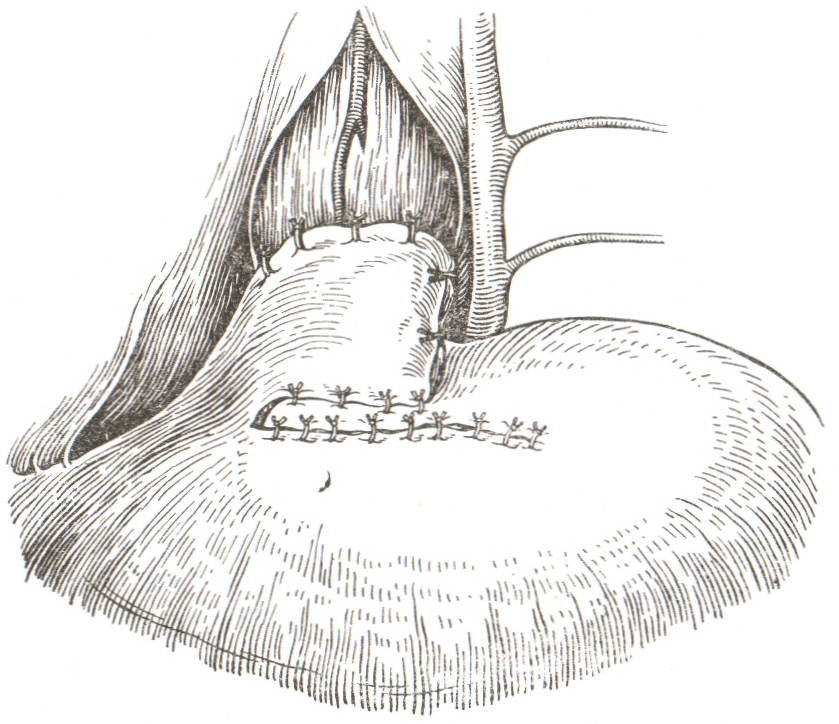
Рис. 7. Кардиопластика диафрагмальным лоскутом по Б.В. Петровскому (Федорова О.Д., 1973): а — будущие разрезы для иссечения мышечной оболочки пищевода, кардии и выкраивания лоскута из диафрагмы;
б — начало подшивания лоскута к мышечным краям пищевода;
в — лоскут полностью подшит, отверстие в диафрагме ушито
Результаты этой операции изучены В.Х. Василенко и соавт. (1976) у 109 больных. Отличные результаты были у 57,2%, хорошие — у 28,6%, удовлетворительные — у 12,2%, рецидив — у 2% больных. Однако при изучении более отдаленных результатов выявлено достаточно частое возникновение пептического эзофагита, язв пищевода, рецидива заболевания вследствие вторичного сморщивания кардии на фоне соединительнотканного перерождения диафрагмального лоскута.
В 1961 г. В.И. Колесов для закрытия мышечного дефекта стал применять большой сальник на питающей ножке. Однако данная методика не получила широкого распространения из-за соединительнотканного перерождения и рубцового сморщивания подшитого сальника и, как следствие, деформации кардии.
В 1957 г. Т.А. Суворова предложила после внеслизистой эзофагокардиомиотомии производить пластику кардии стенкой желудка (рис. 8).
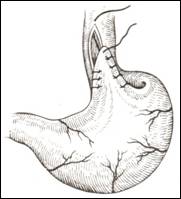
Операцию эзофагокардиогастропластики в последующем модифицировали Б.А. Королев и А.И. Симанович (1960), Ю.Е. Бере- зов и Е.В. Потемкин (1961), А.Н. Беркутов и К.Г. Табадзе (1962). По мнению многих авторов, стенка желудка является идеальным материалом для пластики кардии в связи с тем, что не подвержена рубцовым изменениям, прирастает к слизисто-подслизистому слою нежной прослойкой соединительной ткани и надежно прикрывает даже сквозные ранения слизистой оболочки, хорошо удерживает диастаз мышц пищевода на необходимом расстоянии.
Отдельные хирурги для замещения дефекта мышц пищевода используют серозно-мышечный лоскут, выкроенный из передней стенки желудка на сосудистой ножке (Ганичкин А.М., Джинчарадзе З.С., 1983; Мирошников Б.И., 1990). Однако при этом не достигается каких-либо преимуществ перед способом Т.А. Суворовой, выкраивание лоскута лишь усложняет операцию и удлиняет ее время.
К.И. Мышкин и соавт. (1990) сообщают о 50 операциях по Т.А. Суворовой. В 94% случаев отмечены хорошие результаты в отдаленные сроки, в 6% случаев — рецидив заболевания. В.П. Долгих и А.А. Задорожный (1990) сообщают об успешном лечении 32 больных. У 12 пациентов в отдаленные сроки результаты оценены как отличные, у 20 больных — как удовлетворительные. Рецидива дисфагии и развития рефлюкса авторы не отмечают. Несмотря на то, что операция стойко ликвидирует дисфагию, она не является антирефлюксной. Частота послеоперационного рефлюкс-эзофагита достигает 3–30%.
Для усиления замыкательной функции кардии предложены различные варианты фундопликаций (Stulhofer M., 1977; Черноусов А.Ф., Чернявский А.А., 1986; Vara-Thorbeck R. et al., 1989).
Одна из таких операций — внеслизистая эзофагокардиотомия с фундопликацией по Ниссену — предложена Rossetti в 1963 г. и включает следующие важные элементы:
- внеслизистую миотомию по Геллеру (ликвидирует непроходимость кардии);
- мобилизацию кардии и низведение абдоминального отдела пищевода в брюшную полость (в известной степени выравнивают удлиненный и искривленный пищевод);
- подведение фундального отдела желудка к задней поверхности пищевода и последующее ушивание желудочной стенки вокруг пищевода и кардии (прикрывают дефект в мышечной оболочке и создают предельно острый угол Гиса).
Несмотря на относительную простоту выполнения, операция дает многочисленные осложнения: пилороспазм, язвы желудка и двенадцатиперстной кишки, гиперфункцию или соскальзывание фундопликационной манжетки с развитием рефлюкс-эзофагита; образование скользящей грыжи пищеводного отверстия диафрагмы. Большинство этих осложнений обусловлено постоянной травматизацией манжеткой стволов и ветвей блуждающих нервов или прямым повреждением последних.
Для профилактики рефлюкс-эзофагита F. Holle, S. Andersson (1974) предложили дополнять кардиомиотомию селективной проксимальной ваготомией (СПВ). В связи с этим А.Ф. Черноусов и А.А. Чернявский (1986) разработали наиболее оптимальный, на их взгляд, вариант антирефлюксной кардиопластической операции: кардиомиотомию в сочетании с СПВ и коррекцией кардии (рис. 9).
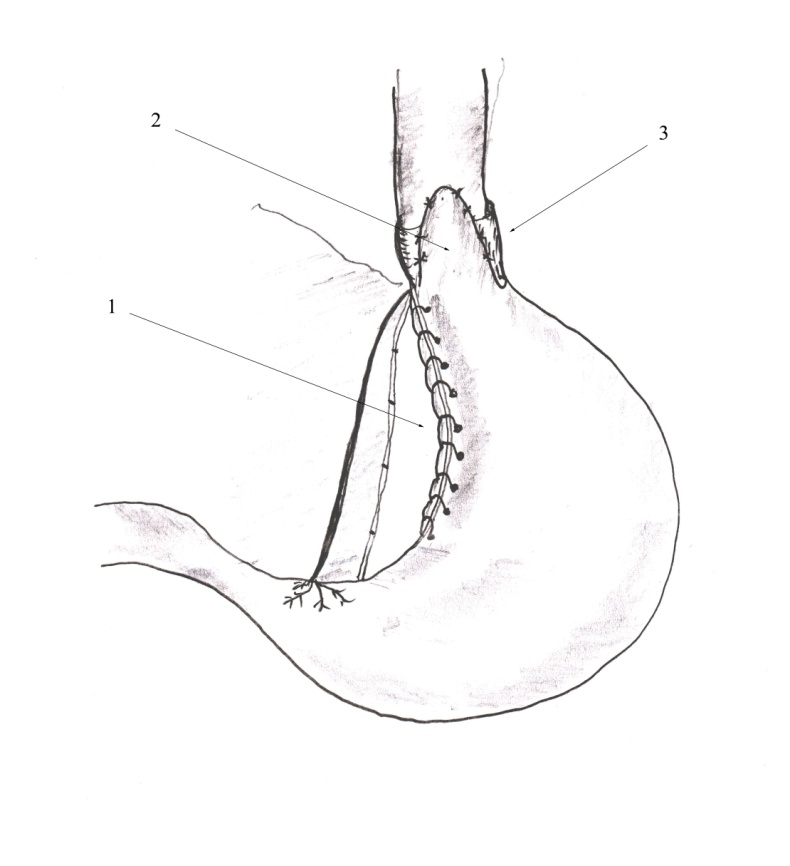
При этом осуществляют послойное скелетирование малой кривизны желудка, начиная чуть проксимальнее места вхождения в антральный отдел последней ветви переднего нерва Латарже. После выполнения СПВ и кардиомиотомии мышечный дефект пищевода на всем протяжении прикрывают передней стенкой дна желудка. Затем двумя-тремя швами между передней и задней стенками дна желудка с захватом мышечной оболочки пищевода формируют фундопликационную манжетку на протяжении 2 см (не более) абдоминального отдела пищевода.
Целесообразность такой неполной фундопликации авторы объясняют тем, что различные виды эзофагофундорафии (простой продольной или 1/2 окружности пищевода), выполненные на уровне эзофагокардиомиотомии, не гарантируют от возникновения желудочно-пищеводного рефлюкса. В то же время классическая фундопликация по Ниссену, получившая широкое распространение при хирургическом лечении рефлюкс-эзофагита, создает слишком сильный клапанный затвор, преодоление которого затруднено для функционально неполноценной при ахалазии моторики пищевода. При IV стадии с удлиненным и S-образным пищеводом для достижения хорошего опорожнения авторы предлагают выпрямлять деформированный сегмент пищевода путем чрезбрюшинной мобилизации наддифрагмального его изгиба с низведением в брюшную полость и фиксацией кардии к круглой связке печени. При гиперацидности, которая встречается у 80% пациентов, авторы выполняют СПВ; при отсутствии показаний послойно скелетируется только область кардиального отдела желудка.
У 3 из 12 больных, оперированных этим методом, был зафиксирован рецидив заболевания, а у 2 — рефлюкс-эзофагит. Причины рецидива, по мнению А.Ф. Черноусова и соавт., это стяжение краев рассеченных мышц из-за образования грубого рубца после операции Геллера, соединительнотканное перерождение и замещение пластического материала после кардиопластических операций, периэзофагеальный фиброз, вызванный гематомой или локальным воспалением, грубая оперативная техника. Как видно, причины поздних рецидивов дисфагии зависят от способа оперативного лечения, вида пластического материала при замещении мышечного дефекта, а также от мастерства хирурга.